Po przecięciu nerwów obwodowych kończyny górnej i leczeniu chirurgicznym niektórzy pacjenci odzyskują dobrą funkcję czuciowo-ruchową, a inni nie. Zrozumienie peryferyjnych i centralnych mechanizmów przyczyniających się do powrotu do zdrowia może ułatwić opracowanie nowych interwencji terapeutycznych. W zwierzęcych modelach uszkodzenia nerwów wykazano plastyczność po przecięciu nerwów obwodowych w całej osi nerwowej. Jednakże zmiany w mózgu, które zachodzą po przecięciu nerwów obwodowych i naprawie chirurgicznej u ludzi, nie zostały zbadane. Co więcej, nie scharakteryzowano zakresu, w jakim regeneracja nerwów obwodowych wpływa na funkcjonalne i strukturalne zmiany w mózgu. Dlatego zapytaliśmy, czy zmianom funkcjonalnym towarzyszą zmiany strukturalne istoty szarej i/lub białej i czy zmiany te wiążą się z regeneracją sensoryczną? Aby rozwiązać te kluczowe problemy, (i) oceniliśmy regenerację nerwów obwodowych; (ii) zmierzoną aktywację mózgu za pomocą funkcjonalnego rezonansu magnetycznego (sygnał zależny od poziomu tlenu we krwi; BOLD) w odpowiedzi na bodziec wibrodotykowy; (iii) zbadano plastyczność strukturalną istoty szarej i białej mózgu; oraz (iv) skorelowane środki odzyskiwania czucia ze zmianami w istocie szarej u pacjentów po przecięciu nerwów obwodowych i zabiegach chirurgicznych. W porównaniu ze zdrowym nerwem przeciwstawnym każdego pacjenta, przecięte nerwy mają upośledzone przewodzenie nerwowe 1.5 roku po przecięciu i naprawie, przewodząc ze zmniejszoną amplitudą i zwiększonym opóźnieniem. W porównaniu ze zdrową grupą kontrolną, u pacjentów po przecięciu nerwów obwodowych i zabiegach chirurgicznych zmieniono aktywność sygnału zależnego od poziomu tlenu we krwi w pierwotnej i wtórnej korze somatosensorycznej po stronie przeciwnej oraz w zestawie obszarów mózgu znanych jako „sieć zadaniowa”. Ponadto zidentyfikowano redukcję istoty szarej w kilku obszarach mózgu, w tym w pierwotnej i wtórnej korze somatosensorycznej po stronie przeciwnej, w tych samych obszarach, w których stwierdzono zmniejszenie sygnału zależne od poziomu tlenu we krwi. Co więcej, rozrzedzenie istoty szarej w zakręcie pośrodkowym zostało ujemnie skorelowane z pomiarami regeneracji sensorycznej (wykrywanie mechaniczne i wibracyjne), wykazując wyraźny związek między funkcją a strukturą. Na koniec zidentyfikowaliśmy zmniejszoną anizotropię frakcyjną istoty białej na prawej wyspie w regionie, który również wykazywał zmniejszoną zawartość istoty szarej. Wyniki te dostarczają wglądu w plastyczność mózgu oraz zależności między strukturą, funkcją i zachowaniem po uszkodzeniu nerwu, a także mają ważne implikacje terapeutyczne.
Słowa kluczowe: grubość kory; fMRI; obrazowanie tensora dyfuzji; plastyczność; uszkodzenie nerwów obwodowych
Skróty: BA=obszar Brodmanna; POgrubione=zależne od poziomu tlenu we krwi; fMRI=funkcjonalny rezonans magnetyczny;
PNIr = przecięcie nerwu obwodowego i naprawa chirurgiczna; S1 = pierwotna kora somatosensoryczna; S2 = wtórna kora somatosensoryczna
Spis treści
Wprowadzenie
Po przecięciu nerwów obwodowych i naprawie chirurgicznej kończyny górnej (PNIr) około 25% pacjentów nie wróciło do pracy 1.5 roku po operacji (Jaquet i in., 2001). Ponadto około 57% pacjentów z uszkodzeniami nerwów jest w wieku od 16 do 35 lat (McAllister i in., 1996); dlatego przecięciu nerwu kończyny górnej może towarzyszyć długa niepełnosprawność i trudności ekonomiczne. Zrozumienie ośrodkowych i obwodowych konsekwencji uszkodzenia nerwów obwodowych może ułatwić opracowanie nowych strategii terapeutycznych i programów interwencyjnych.
Nie wiadomo, jak mózg reaguje na PNIr u ludzi. Jednakże badania na zwierzętach wykazały, że plastyczność w korze somatosensorycznej rozpoczyna się natychmiast po przecięciu nerwów obwodowych oraz że rok po całkowitym przecięciu nerwu i naprawie chirurgicznej mapy korowe zawierają niejednolite, nieciągłe reprezentacje przeciętych i sąsiadujących nerwów (Wall i in. ., 1). Uważa się, że mechanizmy ułatwiające plastyczność funkcjonalną obejmują natychmiastowe zdemaskowanie istniejących wcześniej projekcji z sąsiednich poziomów korowych i podkorowych oraz długotrwałe kiełkowanie aksonów na wielu poziomach osi nerwowej, w tym w pierwotnej korze somatosensorycznej (S1986) (Florence i Kaas , 1; Hickmott i Steen, 1995).
Badania obrazowania ludzkiego mózgu potwierdziły wyniki badań na modelach zwierzęcych wraz z identyfikacją zmienionych funkcjonalnych map aktywacji MRI w wyniku uszkodzenia rdzenia kręgowego, amputacji, przeniesienia palca na kciuk oraz u pacjentów z zespołem cieśni nadgarstka (Lotze i in., 2001; Manduch i in., 2002; Jurkiewicz i in., 2006; Napadow i in., 2006). Co więcej, w badaniach strukturalnych MRI ostatnio uwidoczniono zmiany w istocie szarej i białej po urazach urazowych oraz w różnych stanach patologicznych, w tym po amputacji kończyn i przewlekłym bólu (Apkarian i in., 2004; Draganski i in., 2006; Davis i in., 2008; Geha i in., 2008; maj 2008). Uważa się, że zmiany w istocie szarej są związane ze zmianami w wielkości komórek, atrofią i/lub utratą neuronów lub glejów, podczas gdy na zmiany w istocie białej wpływa zwyrodnienie aksonów i utrata mieliny (Beaulieu, 2002; maj, 2008).
Skutecznym podejściem do określenia mechanizmów patologii i plastyczności jest połączenie funkcjonalnych i strukturalnych technik obrazowania istoty szarej i białej. Wcześniej informowaliśmy, że u pacjentów z całkowitym PNIr kończyny górnej zachowały się głębokie deficyty somatosensoryczne, które utrzymują się 41.5 roku po operacji (Taylor i in., 2008a). Na podstawie tych ustaleń uznaliśmy, że u tych pacjentów występują funkcjonalne i strukturalne zmiany w mózgu w kluczowych somatosensorycznych obszarach mózgu. Dlatego w tym badaniu postawiliśmy hipotezę, że pacjenci PNIr będą mieli: (i) zmniejszoną reakcję zależną od poziomu tlenu we krwi (BOLD) na stymulację wibracyjną obszaru przeciętego nerwu, w obszarze S1, który reprezentuje uszkodzoną kończynę górną, oraz w wtórnym kora somatosensoryczna (S2); (ii) odpowiednie zmniejszenie grubości kory w tych obszarach przeciwległych obszarów S1 i S2; (iii) korelację pomiędzy zmianami grubości kory mózgowej a psychofizycznymi miarami funkcji somatosensorycznych (progi detekcji wibracji i dotyku); oraz (iv) zmniejszona ułamkowa anizotropia (miara integralności istoty białej) w istocie białej wchodzącej/wychodzącej z tych somatosensorycznych obszarów kory.
Metody
Tematy
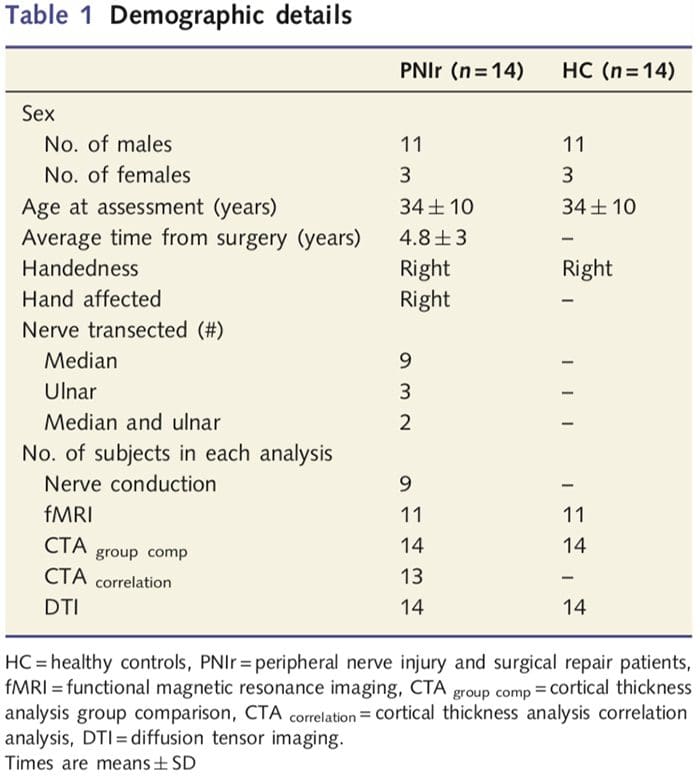
Do badania zrekrutowaliśmy 27 pacjentów z całkowitym przecięciem nerwu pośrodkowego i/lub łokciowego, po którym wykonano operację chirurgiczną u chirurgów plastycznych stowarzyszonych z Programem Ręki Uniwersytetu w Toronto w okresie od czerwca 2006 r. do maja 2008 r. Z tej większej kohorty 14 bezbolesnych pacjentów (trzy kobiety do badania włączono 11 mężczyzn; 34–10 lat) z całkowitym przecięciem prawego nerwu pośrodkowego i/lub łokciowego [aby uniknąć nieporozumień związanych z występowaniem bólu i bocznością, pacjenci z bólem (n=6) i zmianami lewostronnymi (n=7) wykluczono z tej analizy]. Wszyscy pacjenci przeszli mikrochirurgiczną naprawę nerwów co najmniej 1.5 roku przed włączeniem do badania (czas rekonwalescencji wahał się od 1.5 do 8 lat). Ponadto zrekrutowaliśmy 14 zdrowych osób z grupy kontrolnej dobranych pod względem wieku i płci (3 kobiety, 11 mężczyzn; 34–10 lat). Wszyscy badani wyrazili świadomą pisemną zgodę na procedury zatwierdzone przez Radę ds. Etyki Badań Uniwersyteckiej Sieci Zdrowia. Wszyscy badani byli praworęczni (co określono na podstawie inwentarza ręczności w Edynburgu: Oldfield, 1971) i nie cierpieli na żadne urazy neurologiczne ani chroniczny ból w wywiadzie (ani przed, ani po przecięciu nerwu). Szczegóły demograficzne można znaleźć w Tabeli 1.
Projekt badania
Wszyscy pacjenci uczestniczyli w sesji obrazowej, która obejmowała: (i) funkcjonalne obrazowanie metodą rezonansu magnetycznego (fMRI) w odpowiedzi na bodźce wibrotaktyczne przykładane do prawego palca wskazującego (w obrębie nerwu pośrodkowego); (ii) skan anatomiczny całego mózgu o wysokiej rozdzielczości, uzyskany w celu rejestracji obrazu i analizy istoty szarej kory mózgowej; oraz (iii) dwa skany obrazowania tensora dyfuzji w celu oceny integralności istoty białej. Przed obrazowaniem osoby badane zostały poinstruowane na temat podstawowego projektu eksperymentu i przypomniano im, aby przez cały czas trwania badania pozostawali nieruchomo.
Pacjenci mieli możliwość wycofania się z badania w dowolnym momencie. Dodatkowo u wszystkich osób przeprowadzono ocenę sensoryczną i motoryczną (Taylor i in., 2008a). Ponieważ progi wykrywania dotyku i wibracji zostały skorelowane z grubością kory mózgowej, poniżej zawarto opis tych metod (inne pomiary psychofizyczne zostaną opisane w innym miejscu).
Próg wibracji
Progi detekcji wibracji określono za pomocą ręcznego biotezjometru (Bio-Medical Instrument Company, USA). Urządzenie posiada sondę o średnicy 12 mm, którą umieszczono na paliczku dalszym prawego palca wskazującego (D2). Progi wyznaczano metodą granic: amplitudę (napięcie) stopniowo zwiększano, aż badany wskazał, że odbiera bodziec. Progi drgań uzyskano trzykrotnie i obliczono wartość średnią. Podczas badania progu wibracji osoby badane zostały poinstruowane, aby zamknęły oczy i oparły wierzch dłoni na poduszce.
Próg detekcji mechanicznej
Progi detekcji mechanicznej określono przy użyciu standaryzowanego zestawu włókien von Freya (OptiHair2 Marstock Nervtest, Niemcy) zawierającego 12 skalibrowanych włókien w odstępach logarytmicznych, które dostarczały siły od 0.25 do 512 mN. Średnica powierzchni styku wszystkich 12 włókien wynosiła ~0.4 mm. Próby przeprowadzono z zamkniętymi oczami pacjenta i rękami opartymi na miękkiej poduszce. Sondy przykładano w rosnących seriach, a badani musieli reagować za każdym razem, gdy poczuli, że sonda dotyka opuszki palca prawego D2. Proces ten powtórzono trzykrotnie. Siłę działającą na żarnik wykryto w co najmniej dwóch z trzech prób i określono ją jako próg wykrywalności mechanicznej pacjenta.
Badanie przewodnictwa nerwowego
Pacjenci uczestniczyli w obustronnych badaniach przewodzenia nerwów czuciowych i ruchowych w klinice elektromiografii (EMG) szpitala Toronto Western Hospital. W przypadku przewodnictwa nerwu ruchowego elektrodę stymulującą umieszczono na nadgarstku i łokciu (oddzielnie), a elektrodę rejestrującą na mięśniu odwodziciela krótkiego kciuka w przypadku oceny nerwu pośrodkowego lub odwodziciela palców minimi w przypadku oceny nerwu łokciowego. Do badania nerwów czuciowych elektrodę rejestrującą umieszczano na nadgarstku, a elektrodę stymulującą na palcach D2, D3 i D5. Starszy, doświadczony neurolog z kliniki EMG szpitala Toronto Western Hospital (dr Peter Ashby) dokonał przeglądu wszystkich ocen klinicznych, aby określić, które nerwy wykazywały normalne, a które nieprawidłowe reakcje. Ponieważ wiadomo, że miary amplitudy i latencji różnią się znacznie u poszczególnych pacjentów (ze względu na czynniki takie jak gęstość unerwienia, głębokość nerwu i grubość skóry indywidualnego pacjenta) (Kimura, 2001), nieprzecięty nerw każdego pacjenta służyły jako kontrola własna do porównania z wartościami od strony przeciętej. U pacjentów z wykrywalnymi odpowiedziami przewodnictwa nerwowego przeprowadzono dla par testy t w celu oceny różnicy w pomiarach opóźnienia lub amplitudy pomiędzy nerwami przeciętymi i nerwami przeciwstawnymi nieprzeciętymi u każdego pacjenta.
Parametry obrazowania
Dane obrazowania mózgu uzyskano przy użyciu systemu 3T GE MRI wyposażonego w ośmiokanałową cewkę fazowaną. Pacjentów ułożono na wznak na stole do rezonansu magnetycznego, a głowę każdego z nich wyściełano, aby ograniczyć ruch. Dane fMRI całego mózgu uzyskano za pomocą obrazowania planarnego echa (28 przekrojów osiowych, pole widzenia (FOV) = 20 x 20 cm, matryca 64 x 64, woksele 3.125 x 3.125 x 4 mm, czas echa (TE) = 30 ms, powtórzenie czas (TR) = 2000 ms). Czas skanowania wynosił 5 minut i 8 s (154 klatki). Podczas skanowania zastosowano bezbolesny bodziec wibrodotykowy o częstotliwości 12 Hz na dalszy paliczek prawego D2 za pomocą membran balonowych napędzanych sprężonym powietrzem (urządzenie wyprodukowane przez dr Christo Panteva; www.biomag.uni-muenster.de). Bodźce dostarczano w blokach po 10 sekund przeplatanych 20 sekundami odpoczynku, co dało w sumie 10 bloków stymulacji i 10 bloków odpoczynku. Pierwsze 8 s (4 TR) danych uzyskanych z każdej serii odrzucono, aby umożliwić zrównoważenie sygnału fMRI. Badani zostali poinstruowani, aby podczas skanowania mieli zamknięte oczy i skupiali się na bodźcach. Uzyskano trójwymiarowy (3D) skan anatomiczny całego mózgu o wysokiej rozdzielczości (124 przekroje strzałkowe, 24 x 24 cm FOV, matryca 256 x 256, woksele 1.5 x 0.94 x 0.94 mm) za pomocą sekwencji echa 1D zepsutego gradientu ważonego T3 (średnia z jednego sygnału, kąt odchylenia = 20Ω, TE ?5 ms). Dodatkowo wykonano dwa skany obrazowania tensora dyfuzji (38 przekrojów osiowych, pole widzenia 24 x 24 cm, matryca 128 x 128, woksele 1.875 x 1.875 x 3 mm) w 23 kierunkach z wartością b wynoszącą 1000smm². Każda seria zawierała również dwa tomy bez ważenia dyfuzji.
Analiza fMRI
Dane analizowano przy użyciu Brainvoyager QX v1.8 (Brain Innovaton, Maastricht, Holandia). Przetwarzanie wstępne obejmowało: korekcję ruchu 3D, korekcję czasu skanowania wycinka, usuwanie trendu liniowego, filtrowanie górnoprzepustowe (pięć cykli na przebieg) i wygładzanie przestrzenne z jądrem Gaussa o pełnej szerokości 6 mm i połowie maksimum (FWHM). Zestawy danych fMRI interpolowano do wokseli 3 x 3 x 3 mm, zarejestrowano w obrazie anatomicznym o wysokiej rozdzielczości i znormalizowano do standardowej przestrzeni Talairacha (Talairach i Tournoux, 1988). Woksele są podawane jako 1 x 1 x 1 mm. Dane analizowano przy użyciu ogólnego modelu liniowego; model otrzymano poprzez splot funkcji pudełkowej przebiegu czasowego stymulacji dotykowej ze standardową funkcją odpowiedzi hemodynamicznej. Aby zidentyfikować różnice między grupami we wzorcach aktywacji, przeprowadzono analizę efektów stałych z kontrastami: (i) zdrowe kontrole: stymulacja 4 odpoczynek; (ii) PNIr: stymulacja 4 odpoczynek; oraz (iii) zdrowe kontrole 4 PNIr. Mapy aktywacji progowano przy skorygowanej wartości P50.05 (uzyskanej z nieskorygowanych sąsiadujących wokseli P50.0001 i 120 mm3, jak podano wcześniej: Taylor i Davis, 2009); potwierdzono to również poprzez uruchomienie symulacji Monte Carlo z aplikacją AlphaSim zaimplementowaną w oprogramowaniu do analizy neuroobrazu funkcjonalnego (AFNI). Do analizy tej włączono jedynie 11 pacjentów, u których doszło do przecięcia prawego nerwu pośrodkowego (n=9) lub prawego nerwu pośrodkowego i łokciowego (n = 2) (tj. trzech pacjentów z czystym przecięciem prawego nerwu łokciowego nie zostało uwzględnionych w tej analizie ).
Analiza grubości korowej
Analizę grubości warstwy korowej przeprowadzono za pomocą programu Freesurfer (http://surfer.nmr.mgh.harvard.edu); metody zostały szczegółowo opisane w innym miejscu (Dale i in., 1999; Fischl i in., 1999a, b; Fischl i Dale 2000). W skrócie, zestawy danych anatomicznych ważonych T1 o wysokiej rozdzielczości zarejestrowano w atlasie Talairach (Talairach i Tournoux, 1988). Następnie nastąpiła normalizacja intensywności, rozbiórka czaszki i rozdzielenie półkul. Następnie zidentyfikowano i podzielono na segmenty granicę istoty białej/szarej (zwanej białą powierzchnią) i szarej/CSF (zwanej powierzchnią pialu). Następnie w każdym punkcie każdej półkuli mózgu obliczono odległość pomiędzy powierzchnią białą i piłką. Aby zidentyfikować różnice grupowe między 14 pacjentami a 14 grupą kontrolną dobraną pod względem wieku/płci, w każdym punkcie mózgu przeprowadzono ogólną analizę modelu liniowego. Ponieważ topografia kory mózgowej jest z natury niejednorodna, przed analizą statystyczną zastosowano jądro wygładzające przestrzenne FWHM o grubości 5 mm. Dane są wyświetlane przy skorygowanym P50.05 (pochodzącym z nieskorygowanego P50.0075 i 102 sąsiadujących wierzchołków); obliczono to, przeprowadzając symulację Monte Carlo za pomocą AlphaSim. Wierzchołek reprezentuje punkt na dwuwymiarowym arkuszu, a w tym badaniu odległość między dwoma wierzchołkami wynosi 0.80 mm2.
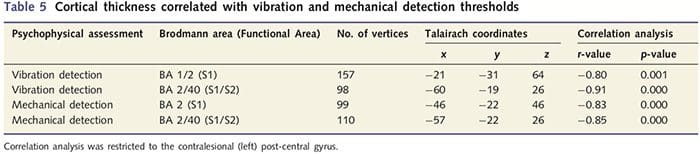
Ponieważ pacjenci wykazywały znaczne deficyty w funkcji somatosensorycznej w obszarze przeciętego nerwu, postawiliśmy hipotezę, że miary funkcji somatosensorycznej (wykrywanie wibracji i dotyku) będą korelować z grubością kory w przeciwległym zakręcie post-centralnym (pierwotna i wtórna kora somatosensoryczna). Dlatego w grupie pacjentów przeprowadziliśmy analizy korelacji pomiędzy: (i) grubością kory mózgowej a progiem detekcji drgań; oraz (ii) grubość kory mózgowej i progi wykrywania dotyku. Jeden pacjent nie ukończył oceny psychofizycznej; dlatego też analiza ta objęła 13 pacjentów korzystających z PNIr. Ponadto, aby określić, czy istnieje związek pomiędzy grubością kory mózgowej a czasem regeneracji, przeprowadzono również analizę korelacji pomiędzy tymi dwoma pomiarami. Te analizy korelacji ograniczono do przeciwległego zakrętu zaśrodkowego poprzez włączenie maski (pobranej z atlasu wbudowanego w Freesurfer) do ogólnego modelu liniowego. Przeprowadzono symulację Monte Carlo, która była ograniczona do liczby wierzchołków w obrębie przeciwległego zakrętu zaśrodkowego; obrazy są wyświetlane z poprawionym P50.05 (pochodzącym z nieskorygowanego P50.0075 i 68 sąsiadujących wierzchołków).
Analiza obrazowania tensora dyfuzji
Przetwarzanie obrazu tensora dyfuzji przeprowadzono za pomocą DTiStudio (www.MriStudio.org) i FSLv.4.0 (www.fmrib.ox.ac.uk/fsl/). Obrazy zostały najpierw ponownie wyrównane za pomocą narzędzia Automatycznej Rejestracji Obrazu zaimplementowanego w DTiStudio, wykorzystując jako szablon pierwszy obraz B0 z pierwszej serii. Proces ten koryguje ruch obiektu i zniekształcenia wywołane prądami wirowymi. Wszystkie obrazy następnie sprawdzono wizualnie, aby ocenić jakość obrazu i wyrównanie oddzielnych przebiegów obrazowania tensora dyfuzji. Jeżeli wykryto artefakt, wycinek usuwano przed obliczeniem średniej z dwóch oddzielnych przebiegów obrazowania tensora dyfuzji. Poszczególne mapy FA obliczono za pomocą narzędzia DTIFIT zaimplementowanego w FSL. Przeprowadzono analizę statystyczną wokseli w celu zidentyfikowania różnic między grupami w średniej anizotropii frakcyjnej przy użyciu statystyki przestrzennej opartej na pasach; pełny opis tych metod można znaleźć w Smith et al. (2006). W skrócie, obrazy zarejestrowano nieliniowo w obrazie docelowym (MNI152), następnie utworzono średni obraz ze wszystkich zbiorów danych, a następnie obraz ten został rozcieńczony, aby reprezentował wszystkie obszary wspólne dla wszystkich pacjentów. Następnie na szkielet rzutowano najwyższe ułamkowe wartości anizotropii każdego pacjenta, przeszukując istotę białą prostopadle do każdego punktu szkieletu istoty białej. Następnie przeprowadzono analizę statystyczną całego mózgu w oparciu o woksele pomiędzy grupami (14PNIr i 14 zdrowych osób kontrolnych), a obrazy całego mózgu skorygowano przy P50.05. Ponadto przeprowadzono analizę obszaru zainteresowania w istocie białej trakty przylega do przeciwległego S1, wzgórza oraz obustronnej przedniej i tylnej wyspy. Regiony te wybrano, ponieważ wcześniej powiązano je z aspektami odczuwania somatosensorycznego i ponieważ odpowiadają regionom zidentyfikowanym w analizach grupowych fMRI i analizie grubości kory mózgowej (CTA). Interesujące obszary narysowano na szkielecie istoty białej w następujący sposób: (i) Przeciwległy obszar zainteresowania S1 powstał przyśrodkowo w miejscu połączenia pomiędzy szkieletem istoty białej korony promienistej a sekcją szkieletu wchodzącą w zakręt pośrodkowy; kończące się na końcu odcinka w obrębie danego wycinka.
W kierunku z obszar zainteresowania rozciągał się od z=49 do 57; drogi istoty białej zaopatrujące obszar dłoni. (ii) Przeciwległy obszar wzgórza będący przedmiotem zainteresowania ograniczał się do ścieżek istoty białej otaczających tylne i środkowe jądra wzgórza (jądra zaangażowane w funkcje somatosensoryczne), rozciągając się od z = �1 do 4. (iii) Wyspiarskie obszary zainteresowania narysowano obustronnie w obrębie istota biała przylegająca do wyspy przedniej i tylnej na podstawie kryteriów opublikowanych wcześniej przez nasze laboratorium (Taylor i in., 2008b). Obszar zainteresowania rozciągał się od z = 2 do 8. Z każdego z tych obszarów zainteresowania wyodrębniono ułamkowe wartości anizotropii i przeprowadzono wielowymiarową analizę wariancji (MANOVA) przy użyciu pakietu statystycznego dla nauk społecznych wersja 13.0 (SPSS Inc, Chicago), które obejmowało ułamkowe wartości anizotropii dla wszystkich sześciu obszarów zainteresowania.
Efekt
Tabela 1 przedstawia dane demograficzne uczestników badania. U wszystkich 14 pacjentów doszło do całkowitego przecięcia prawego nerwu pośrodkowego i/lub łokciowego, po którym nastąpiła naprawa mikrochirurgiczna co najmniej 1.5 roku przed włączeniem do badania. Czas od operacji do badania wahał się od 1.5 do 8 lat, ze średnią (SD) 4.8 ? 3 lata. Pacjenci i grupa kontrolna nie (34–10 lat w obu grupach; t = 0.04; P = 0.97).
Psychofizyka
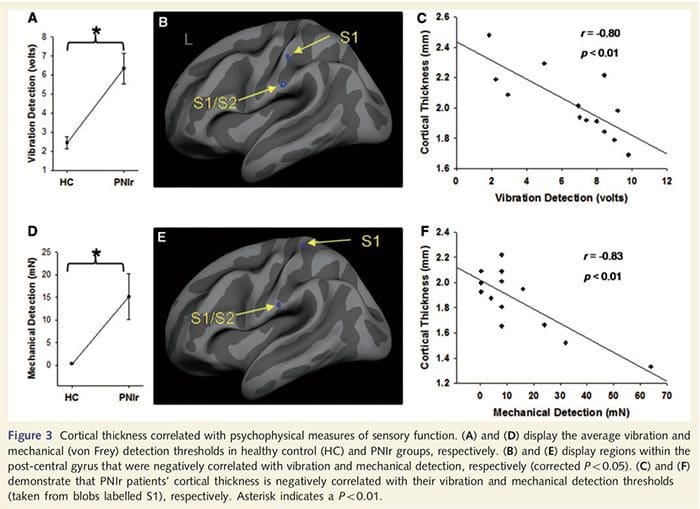
Progi wibracji obliczono na podstawie wszystkich trzech pomiarów, ponieważ jednokierunkowa analiza wariancji z powtarzanymi pomiarami (ANOVA) nie wykazała znaczących różnic pomiędzy trzema próbami [F (25, 1) = 0.227, P = 0.64). Progi wibracji i wykrywalności mechanicznej były znacząco obniżone u pacjentów PNIr w porównaniu ze zdrową grupą kontrolną (wibracje: t = 4.77, P50.001, ryc. 3A; mechaniczne: t = 3.10, P = 0.005, ryc. 3D).
Badanie przewodnictwa nerwowego
Pomiary amplitudy i latencji uzyskane z nerwów przeciwstawnych każdego pacjenta zostały sklasyfikowane jako prawidłowe przez doświadczonego neurologa z kliniki EMG Toronto Western Hospital. Dziewięciu z 14 pacjentów ukończyło badanie przewodnictwa nerwowego. Tabela 2 przedstawia średnie dane dotyczące wzrostu/spadku opóźnienia i amplitudy dla przewodzenia nerwu czuciowego od nadgarstka do mięśnia odwodziciela krótkiego kciuka (środkowego) lub mięśnia odwodziciela minimi (łokciowego) oraz przewodnictwa czuciowego od nadgarstka do D2 (środkowego) i D5 ( łokciowy) w porównaniu do każdego pacjenta z nieuszkodzonym nerwem przeciwstawnym. Spośród dziewięciu pacjentów siedmiu miało przecięcia obejmujące nerw pośrodkowy. Spośród tych siedmiu pacjentów u jednego pacjenta nie stwierdzono wykrywalnej odpowiedzi podczas testów motorycznych, a u innego pacjenta nie stwierdzono wykrywalnej odpowiedzi podczas testów sensorycznych.
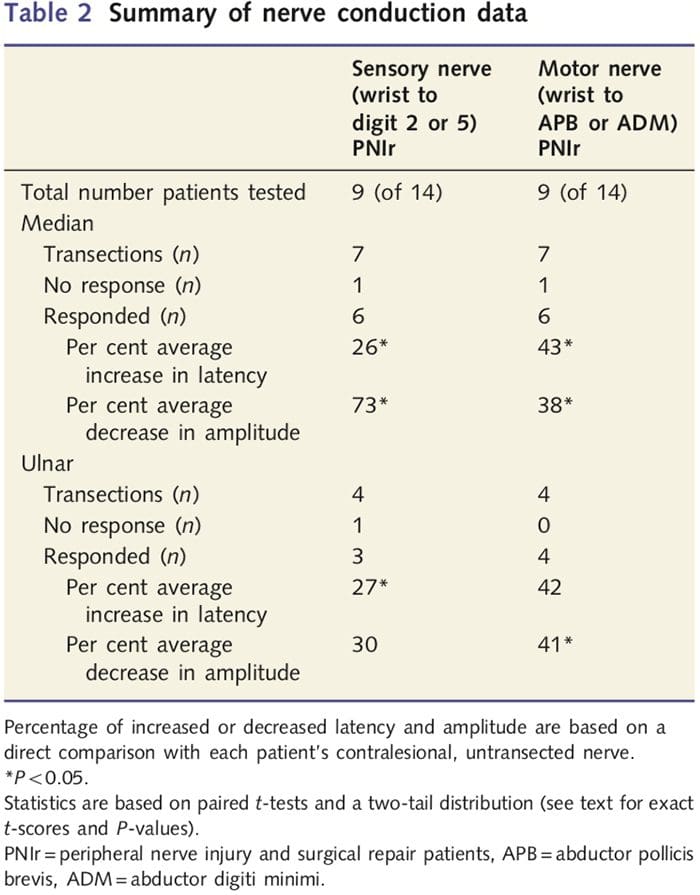 U sześciu pacjentów z wykrywalnymi odpowiedziami opóźnienia przewodzenia ruchowego wzrosły o 43% (t=6.2; P=0.002), a amplitudy zmniejszyły się o 38% (t=~2.6; P=0.045), gdy nerw przecięty u każdego pacjenta w porównaniu do strony, która nie była kontuzjowana. Przewodnictwo czuciowe w nerwach pośrodkowych również ujawniło 26% wzrost opóźnienia (t=3.9; P=0.011) i 73% spadek amplitudy (t=~8.0; P=0.000) w porównaniu z normalnymi nerwami przeciwstawnymi. Spośród czterech pacjentów z przecięciem nerwu łokciowego u jednego pacjenta nie stwierdzono wykrywalnej odpowiedzi podczas badania nerwów czuciowych. U pacjentów, u których wystąpiła odpowiedź, latencja motoryczna nerwu łokciowego nie była znacząco podwyższona (t = 2.8; p = 0.070); jednakże amplitudy były znaczne
U sześciu pacjentów z wykrywalnymi odpowiedziami opóźnienia przewodzenia ruchowego wzrosły o 43% (t=6.2; P=0.002), a amplitudy zmniejszyły się o 38% (t=~2.6; P=0.045), gdy nerw przecięty u każdego pacjenta w porównaniu do strony, która nie była kontuzjowana. Przewodnictwo czuciowe w nerwach pośrodkowych również ujawniło 26% wzrost opóźnienia (t=3.9; P=0.011) i 73% spadek amplitudy (t=~8.0; P=0.000) w porównaniu z normalnymi nerwami przeciwstawnymi. Spośród czterech pacjentów z przecięciem nerwu łokciowego u jednego pacjenta nie stwierdzono wykrywalnej odpowiedzi podczas badania nerwów czuciowych. U pacjentów, u których wystąpiła odpowiedź, latencja motoryczna nerwu łokciowego nie była znacząco podwyższona (t = 2.8; p = 0.070); jednakże amplitudy były znaczne
spadła o 41% (t = �5.9; P = 0.010). Badanie czuciowe nerwu łokciowego wykazało 27% wzrost opóźnienia (t = 4.3; P = 0.049), ale brak istotnego wzrostu amplitudy (t = 3.5; P = 0.072).
Plastyczność funkcjonalna w pierwotnej korze somatosensorycznej
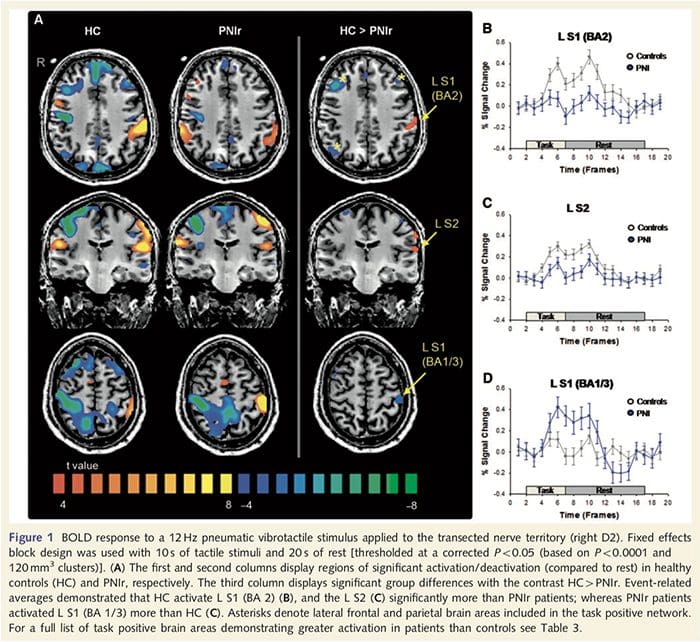
Funkcjonalne mapy MRI obliczono na podstawie 11 pacjentów PNIr z przecięciem prawego nerwu pośrodkowego (pacjenci z przecięciem nerwu łokciowego zostali wykluczeni z tej analizy) i 11 zdrowych osób z grupy kontrolnej dobranych pod względem wieku i płci. Z ryc. 1A jasno wynika, że pacjenci PNIr mają znacznie mniejszą aktywację w porównaniu ze zdrowymi kontrolami w obszarze S1 odpowiadającym obszarowi Brodmanna 2 (BA2) (Talairach i Tournoux, 1988) i S2 (szczegóły patrz Tabela 3). . Średnie odpowiedzi związane ze zdarzeniami z tych obszarów zainteresowania podkreślają osłabioną odpowiedź BOLD u pacjentów – lewy BA2 i lewy S2 (odpowiednio ryc. 1B i C). Co ciekawe, stymulacja wibracyjna u pacjentów aktywowała wyższą część zakrętu pośrodkowego (prawdopodobnie BA1/3) (Talairach i Tournoux, 1988) (ryc. 1A i tabela 3). Średnia związana ze zdarzeniem (ryc. 1D) pokazuje, że zdrowe kontrole miały minimalną aktywację w tym regionie. Co więcej, u pacjentów stwierdzono znacznie większą aktywację w obszarach mózgu zwanych łącznie siecią zadaniową (gwiazdki na ryc. 1). Pełną listę aktywowanych obszarów mózgu odpowiedzialnych za zadanie można znaleźć w Tabeli 3. Sieć ta obejmuje boczną korę przedczołową, boczną ciemieniową, przedruchową i dolną korę skroniową (Tabela 3): obszary mózgu, które są aktywowane podczas wykonywania zadania wymagającego uwagi i tłumione lub nieaktywne podczas odpoczynku lub zadań, które nie stanowią wyzwania poznawczego ani uwagi (Fox i in. in., 2005; DeLuca i in., 2006; Seminowicz i Davis 2007).
Zmniejszona ilość istoty szarej w pierwotnej korze somatosensorycznej koreluje z regeneracją sensoryczną
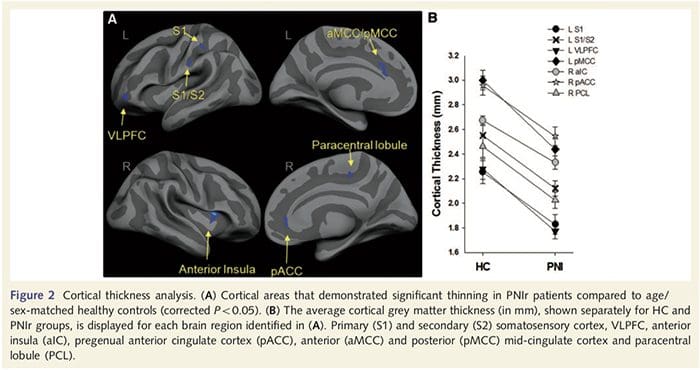
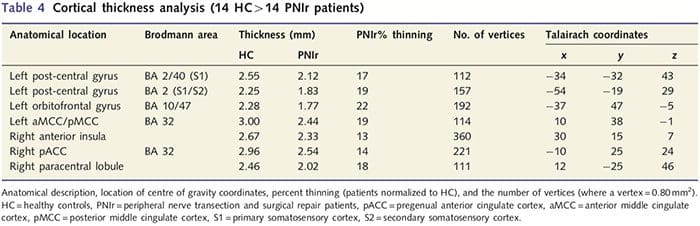
Analiza grubości kory mózgowej u wszystkich 14 pacjentów i 14 zdrowych osób z grupy kontrolnej dobranych pod względem wieku i płci ujawniła kilka miejsc znacznego ścieńczenia kory w grupie PNIr (ryc. 2 i tabela 4). W szczególności u pacjentów zaobserwowano zmniejszenie grubości kory o 13–22% w lewym (przeciwległym) S1, S2, przedkostnym przednim zakręcie obręczy, brzuszno-bocznej korze przedczołowej i prawej przedniej wyspie, przednim/tylnym środkowym zakręcie obręczy i płaciku okołocentralnym. Co ciekawe, lokalizacje przerzedzania istoty szarej w zakręcie pośrodkowym pokrywają się z obszarami zmniejszonego BOLD po stymulacji wibracyjnej (Tabela 4). Ponieważ mieliśmy wcześniejszą wiedzę na temat deficytów czucia pacjentów i czasu powrotu do zdrowia (tj. czasu od naprawy mikrochirurgicznej), zadaliśmy następnie pytanie, czy grubość kory mózgowej pacjentów w zakręcie pośrodkowym koreluje z ich progami czuciowo-mechanicznymi i wykrywalnością wibracji, czy też z ich czas regeneracji. Analizy te wykazały ujemną korelację pomiędzy grubością kory mózgowej a progami wykrywalności drgań w obszarze obejmującym BA1/2 i S2 (P50.001, r=?0.80 i ?0.91, odpowiednio dla BA1/2 i S2; rys. 3 i tabela 5). ). Ponadto progi wykrywalności mechanicznej były również ujemnie skorelowane z grubością kory w nieco wyższym obszarze BA2 i tym samym regionie S2 (P50.001, r = ?0.83 i ?0.85, odpowiednio dla BA2 i S2; ryc. 3 i tabela 5). Nie zidentyfikowaliśmy jednak istotnego związku między czasem rekonwalescencji a grubością kory mózgowej. Dlatego w zakręcie postcentralnym przerzedzenie kory było związane z poważniejszymi deficytami czucia. Nie zidentyfikowaliśmy jednak istotnego związku między czasem rekonwalescencji a grubością kory mózgowej. Ponownie stwierdzono zgodność pomiędzy przerzedzeniem kory w obszarach ujemnie skorelowanych z bodźcami wibracyjnymi a obszarami wykazującymi nieprawidłowości w grupie fMRI i CTA.
Nieprawidłowości istoty białej po przecięciu nerwu
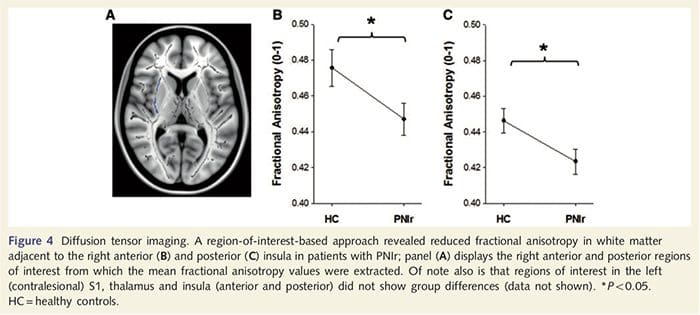
Aby ocenić integralność istoty białej, wykorzystaliśmy podejście oparte na regionie zainteresowania w celu zbadania różnic między grupami istoty białej w oparciu o hipotezy aprioryczne. Obszary zainteresowania ograniczały się do dróg istoty białej otaczających i zasilających przeciwległy S1 i wzgórze. Ponadto narysowaliśmy również obszary zainteresowania istoty białej przylegające do lewej i prawej, przedniej i tylnej wyspy. Wyspę wybrano ze względu na jej udział w przetwarzaniu somatosensorycznym oraz dlatego, że za pomocą CTA zidentyfikowaliśmy zmniejszoną ilość istoty szarej w prawej przedniej części wyspy. Podejście oparte na tym obszarze zainteresowania ujawniło, że pacjenci mieli znacząco zmniejszone wartości frakcyjnej anizotropii istoty białej (MANOVA obejmujące wszystkie sześć obszarów zainteresowania) w sąsiedztwie prawego przedniego odcinka [F (1, 26) = 4.39, P = 0.046; Ryc. 4A] i wyspa tylna [F (1, 26) = 5.55, P = 0.026; Ryc. 4B], ale nie było różnic grupowych w istocie białej przylegającej do lewej wyspy (lewa przednia wyspa: P = 0.51; lewa tylna wyspa: P = 0.26), wzgórza (P = 0.46) lub S1 (P = 0.46 ).
 Dyskusja
Dyskusja
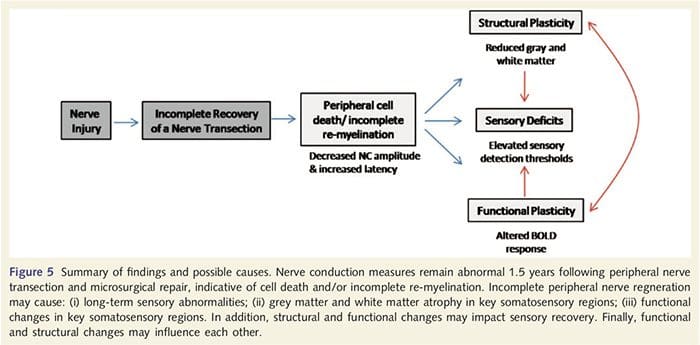
Tutaj po raz pierwszy wykazaliśmy, że po przecięciu nerwów obwodowych kończyny górnej i naprawie chirurgicznej występuje plastyczność funkcjonalna oraz nieprawidłowości strukturalne zarówno istoty szarej, jak i białej w kilku obszarach korowych. Ta plastyczność może wynikać z niepełnej regeneracji nerwów obwodowych (śmierć komórek obwodowych i/lub niepełna remielinizacja), ponieważ pomiary przewodnictwa nerwowego u tych pacjentów wykazały poważne nieprawidłowości. Ponadto nasze dane pokazują, że zmniejszona odpowiedź fMRI wywołana wibracjami w zakręcie pośrodkowym odpowiada rozrzedzeniu istoty szarej w grupie pacjentów. Wyniki te sugerują, że zmniejszoną odpowiedź BOLD można ułatwić poprzez redukcję istoty szarej w korze i/lub zmniejszenie dośrodkowego sygnału wejściowego do zakrętu postśrodkowego. Ponadto grubość kory w tych samych częściach zakrętu pośrodkowego ujemnie korelowała z behawioralnymi pomiarami funkcji somatosensorycznej. Oznacza to, że zwiększone deficyty somatosensoryczne były skorelowane z cieńszą korą; oba mogą być powiązane z wejściem aferentnym. Podsumowując, nasze dane sugerują, że niepełna regeneracja nerwów obwodowych przyczynia się do zaburzeń somatosensorycznych, atrofii istoty szarej korowej i zmniejszonej aktywacji fMRI (podsumowanie tych ustaleń znajduje się na ryc. 5).
Powszechnie wiadomo, że plastyczność kory mózgowej po przecięciu nerwów obwodowych i naprawie chirurgicznej może wystąpić w całym OUN u naczelnych innych niż ludzie (Kaas, 1991). Uważa się, że ta plastyczność jest spowodowana demaskowaniem wcześniej cichych synaps lub kiełkowaniem aksonów na terytorium pozbawione aferencji (Wall i in., 1986; Florence i Kaas, 1995). W modelu naczelnych, rok po przecięciu nerwu i naprawie chirurgicznej, odnerwiona kora charakteryzuje się niekompletną i nieuporządkowaną reprezentacją zregenerowanych i sąsiadujących (nienaruszonych) nerwów. Tę niejednolitą reprezentację przypisuje się niepełnej regeneracji obwodowej, skutkującej częściowym przywróceniem odnerwionej przestrzeni korowej (Kaas, 1). Aby ocenić stopień regeneracji obwodowej w naszej populacji pacjentów, przeprowadziliśmy badania przewodnictwa nerwów czuciowych i ruchowych w obszarze przecięcia. Nasze wyniki przewodnictwa nerwowego pokazują, że pacjenci PNIr mają znacznie zmniejszoną amplitudę i zwiększone opóźnienie zarówno w nerwach czuciowych, jak i ruchowych w porównaniu z ich własną, nieprzeciętą stroną. Zmniejszona amplituda w połączeniu ze zwiększoną latencją wskazuje na utratę włókien obwodowych (tj. śmierć komórki) i/lub nieprawidłową lub niepełną remielinizację po przecięciu (Kimura, 1991). Ponadto dobrze wiadomo, że od 1984% do 20% neuronów zwoju korzenia grzbietowego umiera w wyniku przecięcia nerwu (Liss i in., 50). Zatem śmierć komórek doprowadzających i niepełna regeneracja mogą skutkować zmniejszeniem sygnału doprowadzającego do kory, co może wyjaśniać utrzymujące się deficyty czucia i zmniejszoną odpowiedź BOLD w BA1996 i S2. Co więcej, to zmniejszone wejście aferentne może również wyjaśniać przerzedzenie kory, które zaobserwowaliśmy w tych samych obszarach kory. Wykazano, że deprywacja sensoryczna powoduje zwyrodnienie transneronalne w kilku obszarach OUN, w tym w rogu grzbietowym po odcinku nerwu kulszowego (Knyihar-Csillik i in., 2) i może obejmować neurony drugiego i trzeciego rzędu (Powell i Erulkara, 1989). Zwyrodnienie transneuronalne charakteryzuje się kurczeniem komórek i uważa się, że jest związane ze zmniejszonym lub nieistniejącym wejściem doprowadzającym (Knyihar-Csillik i in., 1962). Zatem utrata (lub atrofia) istoty szarej korowej może być również bezpośrednio powiązana ze zmniejszonym wejściem doprowadzającym.
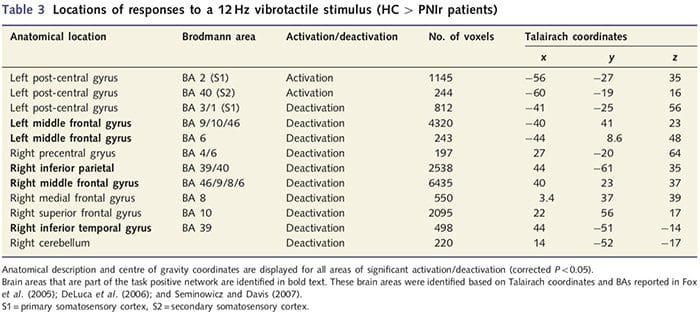
 Wykazaliśmy także zwiększoną aktywację w zakręcie pośrodkowym w obszarze odpowiadającym BA1/3 (Talairach i Tournoux, 1988). Badania elektrofizjologiczne, śledzenie anatomii i neuroobrazowanie wykazały, że dla większości skórnych mechanoreceptywnych włókien doprowadzających pierwszymi miejscami docelowymi w korze są BA1 i BA3b. Każdy z tych cytoarchitektonicznych obszarów mózgu posiada somatotopową mapę ciała z małymi polami recepcyjnymi. Ponadto obszary te reagują na wiele cech informacji dotykowej, takich jak tekstura i szorstkość, prędkość i krzywizna bodźców (Bodegard i in., 2001). Badania fMRI wykazały, że uwaga wpływa na aktywność kory somatosensorycznej w taki sposób, że reakcje fMRI na bodźce dotykowe w S1 są zwiększone, gdy badani skupiają się na bodźcu dotykowym, ale są osłabione, gdy badani są rozproszeni (Arthurs i in., 2004; Porro i in., 2004). Co więcej, nasi pacjenci aktywowali sieć obszarów mózgu zwaną siecią zadań pozytywnych (DeLuca i in., 2006) częściej niż osoby zdrowe. Te obszary mózgu są aktywowane podczas procesów wymagających uwagi (Fox i in., 2005; Seminowicz i Davis, 2007). Łącznie odkrycia te sugerują, że pacjenci muszą bardziej skupiać się na bodźcu niż na grupie kontrolnej ze względu na upośledzone bodźce sensoryczne. Ta zwiększona uwaga może również odpowiadać za zwiększoną aktywację w BA1/3b. Oczywiście zwiększona aktywacja w BA1/3b może również odzwierciedlać plastyczność niezwiązaną z obciążeniem uwagi.
Wykazaliśmy także zwiększoną aktywację w zakręcie pośrodkowym w obszarze odpowiadającym BA1/3 (Talairach i Tournoux, 1988). Badania elektrofizjologiczne, śledzenie anatomii i neuroobrazowanie wykazały, że dla większości skórnych mechanoreceptywnych włókien doprowadzających pierwszymi miejscami docelowymi w korze są BA1 i BA3b. Każdy z tych cytoarchitektonicznych obszarów mózgu posiada somatotopową mapę ciała z małymi polami recepcyjnymi. Ponadto obszary te reagują na wiele cech informacji dotykowej, takich jak tekstura i szorstkość, prędkość i krzywizna bodźców (Bodegard i in., 2001). Badania fMRI wykazały, że uwaga wpływa na aktywność kory somatosensorycznej w taki sposób, że reakcje fMRI na bodźce dotykowe w S1 są zwiększone, gdy badani skupiają się na bodźcu dotykowym, ale są osłabione, gdy badani są rozproszeni (Arthurs i in., 2004; Porro i in., 2004). Co więcej, nasi pacjenci aktywowali sieć obszarów mózgu zwaną siecią zadań pozytywnych (DeLuca i in., 2006) częściej niż osoby zdrowe. Te obszary mózgu są aktywowane podczas procesów wymagających uwagi (Fox i in., 2005; Seminowicz i Davis, 2007). Łącznie odkrycia te sugerują, że pacjenci muszą bardziej skupiać się na bodźcu niż na grupie kontrolnej ze względu na upośledzone bodźce sensoryczne. Ta zwiększona uwaga może również odpowiadać za zwiększoną aktywację w BA1/3b. Oczywiście zwiększona aktywacja w BA1/3b może również odzwierciedlać plastyczność niezwiązaną z obciążeniem uwagi.
 Zarówno BA2, jak i S2 otrzymują projekcje z BA1/3b, a także z odrębnych części brzuszno-tylnego kompleksu wzgórzowego (Pons i in., 1985; Friedman i Murray, 1986). Dwie z tych mózg obszary mają duże, często wielocyfrowe (BA2) lub dwustronne (S2) pola recepcyjne (Pons i in., 1985; Iwamura i in., 2002). W oparciu o projekcje anatomiczne i właściwości odpowiedzi neuronalnej wykazano hierarchiczne przetwarzanie informacji dotykowych od BA1/3b do BA 2 (Kaas i in., 2002). Ponadto badania elektrofizjologiczne na makakach (Pons i in., 1987) oraz dane magnetoencefalograficzne uzyskane u ludzi sugerują, że u wyższych naczelnych seryjne przetwarzanie bodźców dotykowych zachodzi od S1 do S2 (Frot i Mauguiere 1999; Disbrow i in. ., 2001). Kilka badań wykazało, że BA2 jest preferencyjnie aktywowany przez kształt i krzywiznę (Bodegard i in., 2001), podczas gdy S2 może brać udział w uczeniu się dotykowym (Ridley i Ettlinger 1976; Murray i Mishkin, 1984), co potwierdza pogląd, że te obszary mózgu biorą udział w przetwarzaniu somatosensorycznym wyższego rzędu. Nasza ocena psychofizyczna wykazała, że pacjenci mieli znacząco upośledzone wykrywanie prostych bodźców dotykowych oraz test identyfikacji tekstury kształtu 1.5 roku po operacji (Taylor i in., 2008a). Ten ostatni test ocenia zdolność pacjenta do rozpoznawania cech przedmiotu podczas aktywnego badania kształtu lub tekstury, co wymaga integracji informacji sensorycznych z różnych regionów ciała (Rosen i Lundborg, 1998). Podsumowując, jedna z interpretacji naszych danych jest taka, że pacjenci PNIr w większym stopniu skupiają się na bodźcach wibrodotykowych, co prowadzi do zwiększonej aktywacji pozytywnej sieci zadaniowej i BA1/3. Jednak w przypadku tych pacjentów nasze dane sugerują, że obszary przetwarzania wyższego rzędu, takie jak BA2 i S2, nie otrzymały informacji dotykowych, co z kolei może skutkować przerzedzeniem kory mózgowej i zmniejszoną odpowiedzią BOLD.
Zarówno BA2, jak i S2 otrzymują projekcje z BA1/3b, a także z odrębnych części brzuszno-tylnego kompleksu wzgórzowego (Pons i in., 1985; Friedman i Murray, 1986). Dwie z tych mózg obszary mają duże, często wielocyfrowe (BA2) lub dwustronne (S2) pola recepcyjne (Pons i in., 1985; Iwamura i in., 2002). W oparciu o projekcje anatomiczne i właściwości odpowiedzi neuronalnej wykazano hierarchiczne przetwarzanie informacji dotykowych od BA1/3b do BA 2 (Kaas i in., 2002). Ponadto badania elektrofizjologiczne na makakach (Pons i in., 1987) oraz dane magnetoencefalograficzne uzyskane u ludzi sugerują, że u wyższych naczelnych seryjne przetwarzanie bodźców dotykowych zachodzi od S1 do S2 (Frot i Mauguiere 1999; Disbrow i in. ., 2001). Kilka badań wykazało, że BA2 jest preferencyjnie aktywowany przez kształt i krzywiznę (Bodegard i in., 2001), podczas gdy S2 może brać udział w uczeniu się dotykowym (Ridley i Ettlinger 1976; Murray i Mishkin, 1984), co potwierdza pogląd, że te obszary mózgu biorą udział w przetwarzaniu somatosensorycznym wyższego rzędu. Nasza ocena psychofizyczna wykazała, że pacjenci mieli znacząco upośledzone wykrywanie prostych bodźców dotykowych oraz test identyfikacji tekstury kształtu 1.5 roku po operacji (Taylor i in., 2008a). Ten ostatni test ocenia zdolność pacjenta do rozpoznawania cech przedmiotu podczas aktywnego badania kształtu lub tekstury, co wymaga integracji informacji sensorycznych z różnych regionów ciała (Rosen i Lundborg, 1998). Podsumowując, jedna z interpretacji naszych danych jest taka, że pacjenci PNIr w większym stopniu skupiają się na bodźcach wibrodotykowych, co prowadzi do zwiększonej aktywacji pozytywnej sieci zadaniowej i BA1/3. Jednak w przypadku tych pacjentów nasze dane sugerują, że obszary przetwarzania wyższego rzędu, takie jak BA2 i S2, nie otrzymały informacji dotykowych, co z kolei może skutkować przerzedzeniem kory mózgowej i zmniejszoną odpowiedzią BOLD.
Uważa się, że wyspa odgrywa rolę w integrowaniu informacji multimodalnych ważnych dla funkcji sensomotorycznych, emocjonalnych, allostatycznych/homeostatycznych i poznawczych (Devinsky i in., 1995; Critchley, 2004; Craig, 2008) i została nazwana limbiczną korą czuciową (Craig , 2008). W kilku badaniach odnotowano aktywację wysp w odpowiedzi na stymulację dotykową (Gelnar i in., 1998;
Downar i in., 2002) oraz badania anatomiczne u naczelnych wykazały, że wyspa jest wzajemnie połączona z płatami czołowymi, ciemieniowymi i skroniowymi (Augustine, 1996). U naszych pacjentów prawa przednia wyspa była jedynym obszarem korowym, który wykazywał znaczne pocienienie kory w połączeniu ze zmniejszonymi wartościami ułamkowej anizotropii w sąsiadującej istocie białej, co sugeruje, że przerzedzenie kory w tym obszarze jest związane z utratą włókien wystających do lub z tę strukturę. Prawa przednia wyspa odgrywa rolę w interocepcji, ponieważ jest usytuowana tak, aby integrować homeostatyczne bodźce z organizmu z warunkami motywacyjnymi, emocjonalnymi i społecznymi (Craig, 2008). Ponadto Critchley i in. (2004) podali korelację między zdolnościami interoceptywnymi a objętością istoty szarej prawej wyspy przedniej. Biorąc pod uwagę nasze odkrycie, że u pacjentów występuje zmniejszenie istoty szarej w prawej przedniej wyspie, w przyszłym badaniu interesująca byłaby ocena zdolności interoceptywnych po uszkodzeniu nerwów obwodowych.
Podsumowując, po raz pierwszy wykazaliśmy, że zmiany funkcjonalne i strukturalne występują w korze mózgowej człowieka 1.5 roku po całkowitym przecięciu nerwu obwodowego kończyny górnej, który został naprawiony mikrochirurgicznie. Ponadto pomiary przewodnictwa nerwowego wskazują na niepełną regenerację obwodową u tych pacjentów. Ponadto pokazujemy, że grubość kory jest powiązana z psychofizycznymi miarami regeneracji, ponieważ cieńsza kora w obrębie BA2 i S2 była powiązana z gorszą funkcją somatosensoryczną. Dane te sugerują, że przywrócenie prawidłowych map aktywacji funkcjonalnej jest bezpośrednio związane z pomyślną regeneracją obwodowych włókien doprowadzających.
Keri S. Taylor,1,2 Dimitri J. Anastakis2,3,4 i Karen D. Davis1,2,3
1 Division of Brain, Imaging and Behaviour – Systems Neuroscience, Toronto Western Research Institute, University Health Network, Toronto, Kanada M5T258
2 Instytut Nauk Medycznych, Uniwersytet w Toronto, Kanada
3 Katedra Chirurgii, Uniwersytet w Toronto, Kanada
4 Centrum zasobów badań klinicznych, Toronto Western Research Institute, University Health Network, Toronto, Kanada M5T2S8
Korespondencja do: Karen D. Davis, Ph.D.,
Zakład Mózgu, Obrazowania i Zachowania – Systems Neuroscience, Toronto Western Research Institute,
Szpital Zachodni w Toronto,
Uniwersytecka Sieć Zdrowia,
Pokój MP14-306, ulica Bathurst 399,
Toronto, Ontario,
Kanada M5T 2S8
E-mail: kdavis@uhnres.utoronto.ca
Podziękowania
Autorzy dziękują panu Geoffowi Pope, dr Adrianowi Crawleyowi, panu Eugene Hlasny i panu Keithowi Ta za fachową pomoc techniczną. Autorzy pragną podziękować dr Peterowi Ashby’emu i panu Freddy’emu Paizowi z kliniki EMG Toronto Western Hospital za przeprowadzenie badań przewodnictwa nerwowego i fachową ocenę wyników. Autorzy dziękują także doktorom Dvali, Binhammerowi, Fialkovowi i Antonyshynowi za współpracę przy tym projekcie. Dr Davis jest kanadyjskim kierownikiem badań nad mózgiem i zachowaniem (CIHR MOP 53304).
Finansowanie
The Physicians� Services Incorporated i wspólny grant zalążkowy od Centrum Badań nad Bólem Uniwersytetu w Toronto/AstraZeneca.
Materiał uzupełniający
Materiały dodatkowe są dostępne w witrynie Brain online.
pusty
Referencje:
Apkarian AV, Sosa Y, Sonty S i in. Przewlekły ból pleców wiąże się z
zmniejszona gęstość istoty szarej przedczołowej i wzgórzowej. J Neurosci
2004; 24: 10410.
Arthurs OJ, Johansen-Berg H, Matthews PM, Boniface SJ. Uwaga
różnicowo moduluje sprzężenie fMRI BOLD i wywołane
potencjalne amplitudy sygnału w korze somatosensorycznej człowieka 7.
Exp Brain Res 2004; 157: 269, 74.
Augustyn JR. Obwody i aspekty funkcjonalne płata wyspowego
u naczelnych, w tym ludzi. Brain Res Brain Res Rev 1996; 22:
229�44.
Beaulieu C. Podstawy anizotropowej dyfuzji wody w układzie nerwowym
system – przegląd techniczny. NMR Biomed 2002; 15: 435.
Bodegard A, Geyer S, Grefkes C, Zilles K, Roland PE. Hierarchiczny
przetwarzanie kształtu dotykowego w ludzkim mózgu. Neuron 2001; 31:
317�28.
Craig AD. Interocepcja i emocje: perspektywa neuroanatomiczna.
W: Lewis M, Haviland-Jones J, Barrett L, wyd. Podręcznik
emocje. Nowy Jork: Guildford Press; 2008. s. 272.
Critchley HD. Kora ludzka reaguje na wyzwanie interoceptywne.
Proc Natl Acad Sci USA 2004; 101: 6333.
Critchley HD, Wiens S, Rotshtein P, Ohman A, Dolan RJ. Systemy neuronowe
wspieranie świadomości interoceptywnej. Nat Neurosci 2004; 7: 189.
Dale AM, Fischl B, Sereno MI. Analiza powierzchni korowej. I. Segmentacja
i rekonstrukcja powierzchni. Neuroobraz 1999; 9: 179.
Davis KD, papież G, Chen J, Kwan CL, Crawley AP, Diamant NE. Korowy
przerzedzenie w IBS: implikacje dla homeostazy, uwagi i bólu
przetwarzanie. Neurologia 2008; 70: 153.
DeLuca M, Beckmann CF, De SN, Matthews PM, Smith SM. fMRI w spoczynku
sieci stanowe definiują różne tryby interakcji na duże odległości
w ludzkim mózgu. Neuroobraz 2006; 29: 1359, 67.
Devinsky O, Morrell MJ, Vogt BA. Wkład przedniego zakrętu obręczy
korę na zachowanie. Mózg 1995; 118 (cz. 1): 279.
Disbrow E, Roberts T, Poeppel D, Krubitzer L. Dowody na interhemispheric
przetwarzanie danych wejściowych z rąk w ludzkim S2
i PV. J Neurofizjol 2001; 85: 2236, 44.
Downar J, Crawley AP, Mikulis DJ, Davis KD. Wrażliwa sieć korowa
aby pobudzić wyrazistość bodźca w neutralnym kontekście behawioralnym w wielu przypadkach
modalności sensoryczne. J. Neurofizjologia 2002; 87: 615�20.
Draganski B, Moser T, Lummel N i in. Zmniejszenie szarości wzgórza
sprawa po amputacji kończyny. Neuroobraz 2006; 31: 951.
Fischl B., Dale AM. Pomiar grubości ludzkiej kory mózgowej
z obrazów rezonansu magnetycznego. Proc Natl Acad Sci USA 2000; 97:
11050�5.
Fischl B, Sereno MI, Dale AM. Analiza powierzchni korowej. II:
Inflacja, spłaszczenie i powierzchniowy układ współrzędnych.
Neuroobraz 1999a; 9: 195, 207.
Fischl B, Sereno MI, Tootell RB, Dale AM. Temat międzyobiektowy w wysokiej rozdzielczości
uśrednianie i układ współrzędnych powierzchni korowej. Hum mózg
Mapp 1999b; 8: 272, 84.
Florence SL, Kaas JH. Reorganizacja na dużą skalę na wielu poziomach przedsiębiorstwa
Szlak somatosensoryczny następuje po terapeutycznej amputacji ręki
u małp. J. Neurosci 1995; 15: 8083.
Fox MD, Snyder AZ, Vincent JL, Corbetta M, Van E, Raichle ME. The
ludzki mózg jest z natury zorganizowany w sposób dynamiczny i antykorelacyjny
sieci funkcjonalne. Proc Natl Acad Sci USA 2005; 102: 9673.
Friedman DP, Murray EA. Łączność wzgórzowa drugiego
obszar somatosensoryczny i sąsiadujące z nim pola somatosensoryczne
bruzda boczna makaka. J Comp Neurol 1986; 252: 348.
Frot M, Mauguiere F. Czas i rozkład przestrzenny somatosensoryczny
odpowiedzi rejestrowane w górnym brzegu szczeliny Sylwiusza (obszar SII) w
ludzie. Kora Cereba 1999; 9: 854, 63.
Geha PY, Baliki MN, Harden RN, Bauer WR, Parrish TB, Apkarian AV.
Mózg w przewlekłym bólu CRPS: nieprawidłowa istota szaro-biała
interakcje w obszarach emocjonalnych i autonomicznych. Neurona 2008; 60:
570�81.
Gelnar PA, Krauss BR, Szeverenyi NM, Apkarian AV. Reprezentacja palca
w ludzkiej korze somatosensorycznej: badanie fMRI.
Neuroobraz 1998; 7: 261, 83.
Hickmott PW, Steen PA. Wielkoskalowe zmiany w strukturze dendrytycznej
podczas reorganizacji kory somatosensorycznej u dorosłych. Nat Neurosci
2005; 8: 140.
Iwamura Y, Tanaka M, Iriki A, Taoka M, Toda T. Przetwarzanie
sygnały dotykowe i kinestetyczne z obu stron ciała w
zakręt postcentralny u przebudzonych małp. Zachowaj mózg Res 2002; 135:
185�90.
Jaquet JB, Luijsterburg AJ, Kalmijn S, Kuypers PD, Hofman A, Hovius SE.
Uszkodzenia nerwu pośrodkowego, łokciowego i kombinowanego: funkcjonalne
wynik i powrót do produktywności. J Trauma 2001; 51: 687.
Jurkiewicz MT, Crawley AP, Verrier MC, Fehlings MG, Mikulis DJ.
Zanik kory somatosensorycznej po urazie rdzenia kręgowego: oparty na wokselach
badanie morfometrii. Neurologia 2006; 66: 762.
Kaas JH. Plastyczność map sensorycznych i motorycznych u dorosłych ssaków. Annu
Rev Neurosci 1991; 14: 137, 67.
Kaas JH, Jain N, Qi HX. Organizacja układu somatosensorycznego w
naczelne ssaki. W: Nelson RJ, wyd. Układ somatosensoryczny.
Waszyngton, DC: CRC Press; 2002. s. 1.
Kimura J. Elektrodiagnostyka w chorobach nerwów i mięśni: zasady
i ćwiczyć. Oksford: Oxford University Press; 2001.
Kimura J. Zasady i pułapki badań przewodnictwa nerwowego. Annę Neurol
1984; 16: 415.
Knyihar-Csillik E, Rakic P, Csillik B. Zwyrodnienie transneuronalne w
substancja Rolando rdzenia kręgowego naczelnych wywołana przez
Przezzwojowy zanik zwyrodnieniowy ośrodkowego wywołany aksotomią
pierwotne terminale czuciowe. Cell Tissue Res 1989; 258: 515.
Liss AG, af Ekenstam FW, Wiberg M. Utrata neuronów w korzeniu grzbietowym
zwoje nerwowe po przecięciu obwodowego nerwu czuciowego. Anatomiczne
badania na małpach. Scand J Plast Reconstr Surg Hand Surg 1996; 30: 1.
Lotze M, Flor H, Grodd W, Larbig W, Birbaumer N. Ruchy fantomowe
i ból. Badanie fMRI u osób po amputacji kończyny górnej. Mózg 2001;
124: 2268.
Manduch M, Bezuhly M, Anastakis DJ, Crawley AP, Mikulis DJ. Seryjny
fMRI zmian adaptacyjnych w pierwotnej korze sensomotorycznej
rekonstrukcja kciuka. Neurologia 2002; 59: 1278, 81.
Maj A. Przewlekły ból może zmienić strukturę mózgu. Ból 2008;
137: 7.
McAllister RM, Gilbert SE, Calder JS, Smith PJ. Epidemiologia i
Postępowanie w nowoczesnych urazach nerwów obwodowych kończyny górnej
ćwiczyć. J Hand Surg (Br) 1996; 21: 4.
Murray EA, Mishkin M. Względny udział SII i obszaru 5 w dotyku
dyskryminacja u małp 2. Behav Brain Res 1984; 11: 67, 83.
Napadow V, Kettner N, Ryan A, Kwong KK, Audette J, Hui KK.
Plastyczność kory somatosensorycznej w zespole cieśni nadgarstka – przekrój poprzeczny
Ocena fMRI. Neuroobraz 2006; 31: 520.
Oldfield RC. Ocena i analiza ręczności: Edynburg
spis. Neuropsychologia 1971; 9: 97–113.
Pons TP, Garraghty PE, Cusick CG, Kaas JH. Organizacja somatotopowa
obszaru 2 u makaków 6. J Comp Neurol 1985; 241: 445.
Pons TP, Garraghty PE, Friedman DP, Mishkin M. Dowody fizjologiczne
do seryjnego przetwarzania w korze somatosensorycznej. Nauka 1987; 237:
417�20.
Porro CA, Lui F, Facchin P, Maieron M, Baraldi P. Aktywność związana z percepcją
w układzie somatosensorycznym człowieka: funkcjonalny rezonans magnetyczny
badania obrazowe. Obrazowanie metodą rezonansu magnetycznego 2004; 22: 1539, 48.
Powell TP, Erulkar S. Zwyrodnienie komórek transneuronalnych w narządzie słuchowym
jądra przekaźnikowe kota. J Anat 1962; 96: 249, 68.
Ridley RM, Ettlinger G. Upośledzona nauka dotyku i zapamiętywanie po
usunięcie drugiej somatycznej kory projekcyjnej czuciowej (SII) w
małpa. Brain Res 1976; 109: 656.
Rosen B, Lundborg G. Nowy dotykowy instrument gnozy we wrażliwości
testowanie. J Hand The 1998; 11: 251.
Seminowicz DA, Davis KD. Ból poprawia łączność funkcjonalną
sieci mózgowej wywołanej wykonaniem zadania poznawczego.
J. Neurofizjol 2007; 97: 3651.
Smith SM, Jenkinson M, Johansen-Berg H i in. Przestrzenne oparte na traktach
statystyki: analiza wokselowa danych dotyczących rozpowszechniania wśród wielu podmiotów.
Neuroobraz 2006; 31: 1487, 1505.
Talairach J, Tournoux P. Współpłaszczyznowy atlas stereotaktyczny ludzkiego mózgu.
Nowy Jork: Thieme Medical Publishers Inc.; 1988.
Taylor KS, Anastakis DJ, Davis KD. Przewlekły ból po obwodowym
uszkodzenie nerwu wiąże się z katastroficznym bólem i neurotyzmem.
Int Ass Stud Ból 2008a; 267.
Taylor KS, Davis KD. Stabilność fMRI związanego z dotykiem i bólem
Aktywacje mózgu: badanie zależne od progu i
metody niezależne od progu. Mapa mózgu Hum 2009; 30:
1947�62.
Taylor KS, Seminowicz DA, Davis KD. Dwa systemy stanu spoczynku
łączność między wyspą a korą obręczy. Hum mózg
Mapp 2008b;DOI:10.1002/hbm.20705.
Wall JT, Kaas JH, Sur M, Nelson RJ, Felleman DJ, Merzenich MM.
Reorganizacja funkcjonalna w somatosensorycznych obszarach kory 3b i 1
dorosłych małp po naprawie nerwu pośrodkowego: możliwy związek z
regeneracja sensoryczna u ludzi. J. Neurosci 1986; 6: 218, 33.
Zamknij akordeon
Profesjonalny zakres praktyki *
Informacje zawarte w niniejszym dokumencie na temat „Przecięcie nerwu zmienia mózg | El Paso, Teksas.„ nie ma na celu zastąpienia relacji jeden na jeden z wykwalifikowanym pracownikiem służby zdrowia lub licencjonowanym lekarzem i nie jest poradą medyczną. Zachęcamy do podejmowania decyzji dotyczących opieki zdrowotnej na podstawie badań i współpracy z wykwalifikowanym pracownikiem służby zdrowia.
Informacje o blogu i zakres dyskusji
Nasz zakres informacji ogranicza się do leków chiropraktycznych, mięśniowo-szkieletowych, fizykalnych, odnowy biologicznej, przyczyni się do etiologii zaburzenia trzewno-somatyczne w prezentacjach klinicznych, powiązanej dynamice klinicznej odruchu somato-trzewnego, kompleksach podwichnięć, wrażliwych kwestiach zdrowotnych i/lub artykułach, tematach i dyskusjach z zakresu medycyny funkcjonalnej.
Zapewniamy i prezentujemy współpraca kliniczna ze specjalistami z różnych dziedzin. Każdy specjalista podlega zakresowi swojej praktyki zawodowej i jurysdykcji licencyjnej. Stosujemy protokoły funkcjonalnego zdrowia i dobrego samopoczucia, aby leczyć i wspierać opiekę nad urazami lub zaburzeniami układu mięśniowo-szkieletowego.
Nasze filmy, posty, tematy, tematy i spostrzeżenia obejmują kwestie kliniczne, problemy i tematy, które bezpośrednio lub pośrednio odnoszą się do naszego zakresu praktyki klinicznej i wspierają ją.*
Nasze biuro podjęło zasadne próby dostarczenia wspierających cytatów i zidentyfikowało odpowiednie badanie lub badania wspierające nasze posty. Na żądanie udostępniamy kopie badań wspierających, które są dostępne dla organów regulacyjnych i opinii publicznej.
Rozumiemy, że zajmujemy się sprawami, które wymagają dodatkowego wyjaśnienia, w jaki sposób może to pomóc w konkretnym planie opieki lub protokole leczenia; w związku z tym, aby dokładniej omówić powyższy temat, prosimy o kontakt Dr Alex Jimenez, DC, lub skontaktować się z nami pod adresem 915-850-0900.
Jesteśmy tutaj, aby pomóc Tobie i Twojej rodzinie.
Błogosławieństwa
Dr Alex Jimenez OGŁOSZENIE, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionmedicine.com
Licencjonowany jako lekarz chiropraktyki (DC) w Texas & Nowy Meksyk*
Licencja Texas DC nr TX5807, Licencja DC w Nowym Meksyku nr NM-DC2182
Licencjonowana pielęgniarka dyplomowana (RN*) in Floryda
Licencja Florydy Licencja RN # RN9617241 (nr kontrolny 3558029)
Stan kompaktowy: Licencja wielostanowa: Uprawniony do wykonywania zawodu Stany 40*
Dr Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja cyfrowa wizytówka