Rak prostaty: streszczenie
Rak prostaty (PCa) pozostaje główną przyczyną śmiertelności wśród mężczyzn w USA, a częstość występowania nadal rośnie na całym świecie, zwłaszcza w krajach, w których mężczyźni stosują dietę „w stylu zachodnim”. Badania epidemiologiczne, przedkliniczne i kliniczne sugerują potencjalną rolę spożycia pokarmu w występowaniu i progresji PCa. „Ten miniprzegląd zawiera przegląd ostatnio opublikowanej literatury dotyczącej składników odżywczych, czynników żywieniowych, wzorców żywieniowych oraz występowania i progresji PCa. Niskie spożycie węglowodanów, białka sojowego, tłuszczów omega-3 (w-3), zielonej herbaty, pomidorów i produktów z pomidorów oraz zyflamend okazały się obiecujące w zmniejszaniu ryzyka PCa lub progresji. Wyższe spożycie tłuszczów nasyconych i wyższy status ?-karotenu mogą zwiększać ryzyko. Zależność kształtu „U” może istnieć między kwasem foliowym, witaminą C, witaminą D i wapniem z ryzykiem PCa. Pomimo niespójnych i niejednoznacznych ustaleń, potencjalne znaczenie spożycia pokarmu w zapobieganiu i leczeniu PCa jest obiecujące. Połączenie wszystkich korzystnych czynników zmniejszających ryzyko PCa w zdrowym schemacie żywieniowym może być najlepszą radą żywieniową. Ten wzorzec obejmuje bogate owoce i warzywa, zredukowaną ilość rafinowanych węglowodanów, tłuszczów ogółem i nasyconych oraz zredukowaną ilość gotowanego mięsa. Zagwarantowane są dalsze, starannie zaprojektowane badania prospektywne.
Słowa kluczowe: dieta, rak prostaty, składniki odżywcze, schematy żywieniowe, styl życia, zapobieganie, leczenie, odżywianie, interwencje żywieniowe, przegląd
Spis treści
Wprowadzenie: rak prostaty
Rak prostaty (PCa) jest drugim najczęściej występującym nowotworem u mężczyzn, z prawie milionem nowych przypadków diagnozowanych na całym świecie rocznie [1], z około sześciokrotnie wyższą zachorowalnością w krajach zachodnich niż w krajach niezachodnich. Przypuszcza się, że dieta, styl życia, czynniki środowiskowe i genetyczne odgrywają rolę w tych różnicach. Niniejszy przegląd koncentruje się na najnowszych dowodach na potencjalną rolę czynników dietetycznych w PCa i obejmuje dowody z badań epidemiologicznych i klinicznych dotyczących wpływu białka, tłuszczu, węglowodanów, błonnika, fitochemikaliów, innych składników żywności, pełnowartościowej żywności i wzorców żywieniowych na występowanie PCa, rozwój i/lub progresja. W tym przeglądzie podkreślono dane z metaanaliz lub dobrze zaprojektowanych badań randomizowanych i badań prospektywnych. Należy zauważyć, że badania dotyczące spożycia lub żywienia i nowotworów często podlegają różnym ograniczeniom, co komplikuje interpretację wyników. Na przykład, gdy badanie ma na celu zbadanie wpływu ilości spożywanego tłuszczu, zmiana spożycia tłuszczu nieuchronnie zmieni spożycie białka i/lub węglowodanów, a także może zmienić spożycie innych składników odżywczych. W rezultacie trudno jest przypisać efekt samej zmianie spożycia tłuszczu. Ponadto wpływ makroskładników pokarmowych potencjalnie obejmuje aspekty zarówno bezwzględnej ilości, jak i rodzaju spożywanych makroskładników. Oba aspekty mogą potencjalnie niezależnie wpływać na inicjację i/lub rozwój nowotworu, ale nie zawsze można je rozróżnić w projektach badawczych. Chociaż temat ten został niedawno przejrzany [2], biorąc pod uwagę obszerną nową literaturę na ten temat, przedstawiono w nim zaktualizowany przegląd oraz tabelę podsumowującą dla szybkiego odniesienia (Tabela 1).
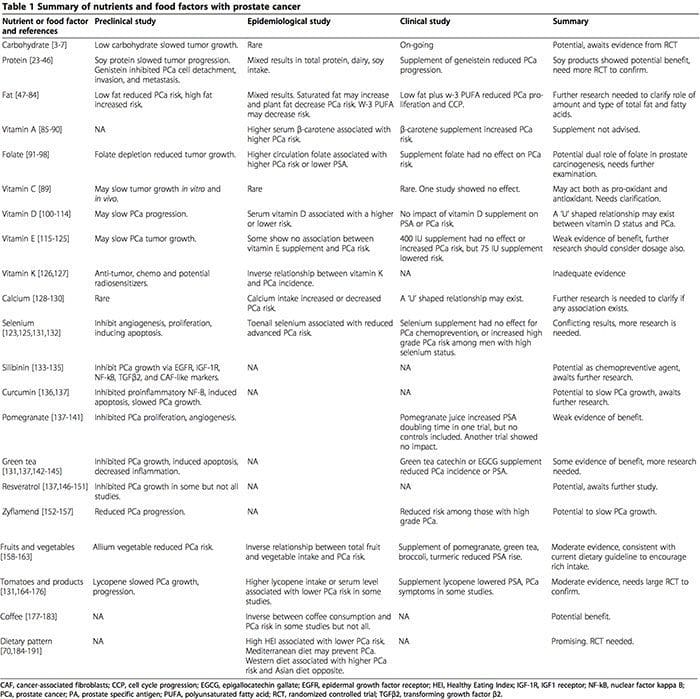
Składniki odżywcze Węglowodany Biorąc pod uwagę hipotezę, że insulina jest czynnikiem wzrostu PCa, wysunięto hipotezę, że redukcja węglowodanów, a tym samym obniżenie poziomu insuliny w surowicy, może spowolnić wzrost PCa [3]. Rzeczywiście, w modelach zwierzęcych albo dieta ketogeniczna bez węglowodanów (NCKD) [4,5], albo dieta niskowęglowodanowa (20% kcal jako węglowodany) ma korzystny wpływ na spowolnienie wzrostu guza prostaty [6,7]. W badaniach na ludziach jedno z badań wykazało, że wysokie spożycie rafinowanych węglowodanów wiązało się ze zwiększonym ryzykiem PCa [7]. Oprócz ilości węglowodanów, rodzaj węglowodanów może wpływać na PCa, ale badania nie są jednoznaczne. Potencjał zmniejszenia ryzyka i progresji PCa poprzez wpływ na metabolizm węglowodanów jest aktywnie badany za pomocą Metforminy. Metformina zmniejszała proliferację komórek PCa i opóźniała progresję odpowiednio in vitro i in vivo [8-10] oraz zmniejszała ryzyko incydentów i śmiertelność u ludzi [11-13]. W dwóch jednoramiennych badaniach klinicznych wykazano również pozytywny wpływ metforminy na markery proliferacji i progresji PCa [14,15]. Jednak inne retrospektywne badania kohortowe nie potwierdziły wpływu metforminy na ryzyko nawrotu lub incydentu PCa [16-22]. Pomimo możliwości zmniejszenia ilości węglowodanów ogółem lub prostych w celu poprawy kontroli PCa, brakuje dowodów z randomizowanych badań kontrolowanych (RCT). Obecnie trwają dwa randomizowane badania dotyczące wpływu diety niskowęglowodanowej (około 5% kcal) na czas podwojenia PSA wśród pacjentów z PCa po prostatektomii radykalnej (NCT01763944) oraz na odpowiedź glikemiczną wśród pacjentów rozpoczynających terapię deprywacji androgenów (ADT) ( NCT00932672). Wyniki tych badań rzucą światło na wpływ spożycia węglowodanów na markery progresji PCa oraz na rolę zmniejszonego spożycia węglowodanów w równoważeniu skutków ubocznych ADT.
Białko
Idealny poziom spożycia białka dla optymalnego ogólnego stanu zdrowia lub prostaty jest niejasny. Pomimo popularności diet o niskiej zawartości węglowodanów, które są bogate w białko, ostatnie badania na ludziach wykazały, że niskie spożycie białka wiązało się z niższym ryzykiem raka i ogólną śmiertelnością wśród mężczyzn w wieku 65 lat i młodszych. Wśród mężczyzn w wieku powyżej 65 lat niskie spożycie białka wiązało się z wyższym ryzykiem zachorowania na raka i ogólną śmiertelnością [23]. W modelach zwierzęcych stosunek białka do węglowodanów miał wpływ na zdrowie kardiometaboliczne, starzenie się i długowieczność [24]. Rola białka pokarmowego i stosunku białka do węglowodanów w rozwoju i progresji PCa wymaga dalszych badań.
Białka pochodzenia zwierzęcego
Badanie spożycia białka, podobnie jak wszystkie aspekty nauki o żywieniu, może być trudne. Na przykład mięso zwierzęce, które jest źródłem białka w dietach zachodnich, składa się nie tylko z białka, ale także z tłuszczu, cholesterolu, minerałów i innych składników odżywczych. Ilość tych składników odżywczych, w tym kwasów tłuszczowych, może się różnić w zależności od mięsa zwierząt. Wcześniejsze badania na ludziach wykazały, że spożywanie drobiu bez skóry, który ma niższą zawartość cholesterolu i tłuszczów nasyconych niż wiele czerwonych mięs, nie było związane z nawrotem lub progresją PCa [25]. Jednak spożycie pieczonego drobiu było odwrotnie proporcjonalne do zaawansowanego PCa [26,27], podczas gdy gotowane czerwone mięso wiązało się ze zwiększonym ryzykiem zaawansowanego PCa [26,27]. Tak więc sposób przygotowania żywności może modyfikować jej wpływ na ryzyko i progresję PCa. Ogólnie rzecz biorąc, spożycie ryb może wiązać się ze zmniejszoną śmiertelnością PCa, ale ryby gotowane w wysokiej temperaturze mogą przyczyniać się do powstawania PCa [28]. Dlatego wskazane może być regularne spożywanie ryb, ale temperatura gotowania powinna być umiarkowana.
Białko na bazie mleka
Innym powszechnym źródłem białka są produkty mleczne, takie jak mleko, ser i jogurt. Wcześniejsze badania wykazały, że nabiał zwiększał ogólne ryzyko PCa, ale nie w przypadku agresywnych lub śmiertelnych PCa [29,30]. Ponadto doniesiono, że zarówno spożycie mleka pełnego, jak i mleka o niskiej zawartości tłuszczu promuje lub opóźnia progresję PCa [29,31, 21,660]. W kohorcie kontrolnej Physicians Health obejmującej 32 1798 mężczyzn całkowite spożycie produktów mlecznych było związane ze zwiększoną częstością występowania PCa [1]. W szczególności mleko o niskiej zawartości tłuszczu lub odtłuszczone zwiększało PCa niskiej jakości, podczas gdy pełne mleko zwiększało ryzyko śmiertelnego PCa. Chociaż dokładny(e) składnik(i) produktów mlecznych wywołujący te skojarzenia nie jest znany, w grę mogą wchodzić wysokie stężenia tłuszczów nasyconych i wapnia. Przekrojowe badanie 33 mężczyzn wykazało, że białko mleka było dodatnio związane z poziomami IGF-XNUMX w surowicy [XNUMX], które mogą stymulować inicjację lub progresję PCa. Dlatego potrzebne są dalsze badania, aby wyjaśnić związek między spożyciem nabiału a PCa. Nie ma wystarczających danych, aby dostarczyć zaleceń dotyczących konkretnie nabiału lub białka mlecznego oraz ryzyka lub progresji PCa.
Białka roślinne
Produkty sojowe i na bazie soi są bogate w białko i fitoestrogeny, które mogą ułatwiać zapobieganie PCa, ale ich rola w PCa jest niejasna. W badaniu na myszach spożycie produktów sojowych wiązało się ze zmniejszeniem aromatazy wątrobowej, 5a-reduktazy, ekspresji receptora androgenowego i jego regulowanych genów, FOXA1, masy układu moczowo-płciowego i progresji guza PCa [34]. Niedawne randomizowane badanie 177 mężczyzn z chorobą wysokiego ryzyka po radykalnej prostatektomii wykazało, że suplementacja białka sojowego przez dwa lata nie miała wpływu na ryzyko nawrotu PCa [35]. Chociaż badania epidemiologiczne i przedkliniczne [36,37, 38] potwierdzają potencjalną rolę izoflawonów sojowych/sojowych w redukcji lub progresji ryzyka PCa, metaanaliza nie wykazała znaczącego wpływu spożycia soi na poziomy PSA, globuliny wiążącej hormony płciowe, testosteron, wolny testosteron, estradiol czy dihydrotestosteron [39]. W innym RCT u pacjentów przed prostatektomią również nie stwierdzono żadnego wpływu suplementacji izoflawonu sojowego do sześciu tygodni na PSA, testosteron całkowity w surowicy, testosteron wolny, estrogen całkowity, estradiol czy cholesterol całkowity [XNUMX]. Ponieważ większość przeprowadzonych badań z randomizacją była niewielka i trwała krótko, potrzebne są dalsze badania.
Wiele badań kontynuowało badanie głównego izoflawonu w soi, genisteiny i jego wpływu na PCa. Opisano potencjał genisteiny do hamowania odwarstwiania, inwazji i przerzutów komórek PCa [40]. Genisteina może modyfikować aktualizację glukozy i ekspresję transportera glukozy (GLUT) w komórkach PCa [41] lub wywierać działanie przeciwnowotworowe poprzez regulację w dół kilku mikroRNA [42]. Badania z wykorzystaniem komórek nowotworowych i modeli zwierzęcych sugerują, że genisteina może konkurować z endogennymi estrogenami i blokować wiązanie się z receptorem estrogenowym, tym samym hamując proliferację komórek, wzrost i indukując różnicowanie, a w szczególności genisteina może hamować odrywanie komórek, produkcję proteaz, inwazję komórek, a tym samym zapobiegać przerzutom [36,40,43]. Jednak ani stężenie genisteiny w osoczu, ani w moczu nie było związane z ryzykiem PCa w badaniach kontrolnych przypadków [44,45]. W drugiej fazie kontrolowanej placebo RCT z udziałem 2 mężczyzn, suplementacja 47 mg genisteiny przez trzy do sześciu tygodni znacząco zmniejszyła związane z androgenem markery progresji PCa [30]. Ponadto genisteina może być korzystna w poprawie chemioterapii kabazytakselem w przerzutowych PCa opornych na kastrację [46]. Uzasadnione są badania kliniczne w celu dalszego zbadania roli soi i izoflawonów sojowych w zapobieganiu lub leczeniu PCa. Ostateczne zalecenie dotyczące spożycia białka w profilaktyce lub leczeniu PCa nie jest jeszcze dostępne.
Tłuszcz
Wyniki badań analizujących spożycie tłuszczu z ryzykiem lub progresją PCa są sprzeczne. Zarówno całkowite bezwzględne spożycie [47] tłuszczu w diecie, jak i względny skład kwasów tłuszczowych mogą niezależnie odnosić się do inicjacji i/lub progresji PCa. Podczas gdy badania na zwierzętach wielokrotnie pokazują, że zmniejszenie spożycia tłuszczu w diecie spowalnia wzrost guza [48-50], a diety wysokotłuszczowe, zwłaszcza tłuszcz zwierzęcy i olej kukurydziany, zwiększają progresję PCa [51], dane dotyczące ludzi są mniej spójne. Badania kliniczno-kontrolne i badania kohortowe wykazały brak związku między całkowitym spożyciem tłuszczu a ryzykiem PCa [52-55] lub odwrotną zależność między spożyciem tłuszczu a przeżyciem PCa, szczególnie wśród mężczyzn z zlokalizowanym PCa [47]. Ponadto badanie przekrojowe wykazało, że spożycie tłuszczu wyrażone jako procent całkowitego spożycia kalorii było pozytywnie powiązane z poziomem PSA u 13,594 56 mężczyzn bez PCa [56]. Biorąc pod uwagę te sprzeczne dane, możliwe jest, że rodzaj kwasu tłuszczowego [14,514], a nie jego całkowita ilość, może odgrywać ważną rolę w rozwoju i progresji PCa. Badanie wykazało, że nasycone kwasy tłuszczowe w osoczu są pozytywnie powiązane z ryzykiem PCa w prospektywnej kohorcie 57 58 mężczyzn z Melbourne Collaborative Cohort Study [XNUMX]. Ponadto inne badanie wykazało, że spożywanie większej ilości tłuszczu roślinnego wiązało się ze zmniejszonym ryzykiem PCa [XNUMX]. Badania te potwierdzają aktualne wytyczne dietetyczne dotyczące spożywania mniejszej ilości tłuszczu pochodzenia zwierzęcego, a większej ilości tłuszczu pochodzenia roślinnego.
Dane dotyczące spożycia wielonienasyconych kwasów tłuszczowych (PUFA) omega-6 (w-6) i omega-3 (w-3) oraz ryzyka PCa również są sprzeczne. Chociaż istnieją dane potwierdzające związek między zwiększonym spożyciem W-6 WKT (pochodzących głównie z oleju kukurydzianego) a ryzykiem ogólnego PCa o wysokiej jakości [57,59], nie wszystkie dane potwierdzają taki związek [60]. W rzeczywistości większe spożycie tłuszczów wielonienasyconych było związane z niższą śmiertelnością ogólną wśród mężczyzn z PCa bez przerzutów w badaniu Health Professionals Follow-up [58]. Postulowanym mechanizmem łączącym W-6 PUFA z ryzykiem PCa jest konwersja kwasu arachidonowego (w-6 PUFA) do eikozanoidów (prostaglandyny E-2, kwasów hydroksyeikozatetraenowych i kwasów epoksyeikozatrienowych) prowadząca do stanu zapalnego i wzrostu komórek [61]. Odwrotnie, W-3 PUFA, które znajdują się głównie w tłustych rybach zimnowodnych, mogą spowalniać wzrost PCa poprzez szereg mechanizmów [61-63]. W badaniu obejmującym 48 mężczyzn z PCa niskiego ryzyka pod aktywnym nadzorem, powtórna biopsja w ciągu sześciu miesięcy wykazała, że kwasy tłuszczowe W-3 w tkance prostaty, zwłaszcza kwas eikozapentaenowy (EPA), mogą chronić przed progresją PCa [64]. Badania in vitro i na zwierzętach sugerują, że W-3 PUFA indukują szlaki przeciwzapalne, proapoptotyczne, antyproliferacyjne i antyangiogenne [65,66]. Co więcej, badanie na myszach porównujące różne rodzaje tłuszczów wykazało, że tylko dieta z olejem rybim (tj. dieta oparta na omega-3) spowolniła wzrost PCa w porównaniu z innymi tłuszczami w diecie [67]. Jeśli chodzi o dane dotyczące ludzi, randomizowane badanie fazy II wykazało, że dieta niskotłuszczowa z suplementacją w-3 na cztery do sześciu tygodni przed radykalną prostatektomią zmniejszyła proliferację PCa i progresję cyklu komórkowego (CCP) [62,68]. Niskotłuszczowa dieta z olejem rybim skutkowała obniżonym poziomem kwasu 15(S)-hydroksyeikozatetraenowego i obniżoną punktacją CCP w porównaniu z dietą zachodnią [69]. Potencjalne korzyści kwasów tłuszczowych omega-3 z ryb są poparte literaturą epidemiologiczną pokazującą, że spożycie kwasów tłuszczowych w-3 było odwrotnie proporcjonalne do śmiertelnego ryzyka PCa [70,71]. Pomimo obietnicy kwasów tłuszczowych omega-3, nie wszystkie badania są zgodne. Suplementacja 2 g kwasu alfa-linolenowego (ALA) dziennie przez 40 miesięcy u 1,622 mężczyzn z PSA <4 ng/ml nie zmieniła ich PSA [72]. Jednak inne badanie wykazało, że wysokie stężenie n-3 PUFA i kwasu dokozapentaenowego (DPA) w surowicy wiązało się ze zmniejszonym całkowitym ryzykiem PCa, podczas gdy wysokie stężenie EPA i kwasu dokozaheksaenowego (DHA) w surowicy było prawdopodobnie związane ze zwiększonym ryzykiem PCa o wysokim stopniu złośliwości [73]. . Konieczne są dalsze badania, aby lepiej zrozumieć rolę kwasów tłuszczowych omega-3 w zapobieganiu lub leczeniu PCa.
cholesterol
Wiele badań przedklinicznych wykazało, że kumulacja cholesterolu przyczynia się do progresji PCa [74-76]. Zasugerowano, że wysoki poziom cholesterolu u Lin et al. BMC Medicine (2015) 13:3 Strona 5 z 15 krążenie może być czynnikiem ryzyka guzów litych, głównie poprzez zwiększenie syntezy cholesterolu, szlaków zapalnych [77] i wewnątrzguzową steroidogenezę [78]. Według niedawnego badania z 2,408 mężczyznami zakwalifikowanymi do biopsji, poziom cholesterolu w surowicy był niezależnie związany z przewidywaniem ryzyka PCa [79]. Zgodnie z ustaleniami dotyczącymi cholesterolu, stosowanie statyn po radykalnej prostatektomii (RP) było istotnie związane ze zmniejszonym ryzykiem nawrotu biochemicznego u 1,146 pacjentów po radykalnej prostatektomii [80]. Inne badanie wykazało również, że statyny mogą zmniejszać ryzyko PCa poprzez zmniejszenie progresji [81]. Chociaż mechanizm nie został ustalony, nowsze badania wykazały również, że niski poziom cholesterolu o dużej gęstości (HDL) wiązał się z wyższym ryzykiem PCa, a zatem wyższy poziom HDL miał działanie ochronne [81-84]. Odkrycia te potwierdzają pogląd, że interwencja dietetyczna, która wpływa na zdrowie serca, obniża poziom cholesterolu, może również korzystnie wpływać na zdrowie prostaty.
Witaminy i minerały
W tym miejscu dokonamy przeglądu najnowszych danych dotyczących witamin A, B kompleksu, C, D, E i K oraz selenu. W dwóch dużych badaniach klinicznych: Caroten and Retinol Efficacy Trial (CARET; PCa był wynikiem drugorzędowym) oraz prospektywnym badaniu kohortowym National Institutes of Health-American Association of Retired Persons (NIH-AARP) Diet and Health, stwierdzono nadmierną suplementację multiwitaminami. związane z wyższym ryzykiem rozwoju agresywnego PCa, szczególnie wśród osób przyjmujących indywidualne suplementy ?-karotenu [85,86]. Podobnie, wysokie poziomy β-karotenu w surowicy były związane z wyższym ryzykiem PCa wśród 997 fińskich mężczyzn w kohorcie czynnika ryzyka choroby niedokrwiennej serca Kuopio [87]. Jednakże nie stwierdzono, aby suplement β-karotenu wpływał na ryzyko śmiertelnego PCa podczas terapii [88] ani w duńskim prospektywnym badaniu kohortowym 26,856 89 mężczyzn [90]. Krążący retinol również nie był związany z ryzykiem PCa w dużym badaniu kliniczno-kontrolnym [XNUMX]. Tak więc związek między witaminą A i PCa jest nadal niejasny.
Dowody przedkliniczne sugerują, że niedobór kwasu foliowego może spowolnić wzrost guza, podczas gdy suplementacja nie ma wpływu na wzrost ani progresję, ale może bezpośrednio prowadzić do zmian epigenetycznych poprzez zwiększenie metylacji DNA [91]. Dwie metaanalizy wykazały również, że poziomy krążącego folianu były pozytywnie powiązane ze zwiększonym ryzykiem PCa [92,93], podczas gdy dieta lub suplementacja folianów nie miała wpływu na ryzyko PCa [94] w badaniu kohortowym 58,279 95 mężczyzn w Holandii. 96] oraz badanie kliniczno-kontrolne we Włoszech i Szwajcarii [97]. W rzeczywistości, jedno badanie kohorty mężczyzn poddawanych radykalnej prostatektomii w kilku ośrodkach Veterans Administration w USA wykazało nawet, że wyższe poziomy kwasu foliowego w surowicy wiązały się z niższym PSA, a tym samym niższym ryzykiem niepowodzenia biochemicznego [2007]. Inne badanie wykorzystujące dane z 2010-XNUMX National Health and Odżywianie Badanie ankietowe wykazało, że wyższy status kwasu foliowego może chronić przed podwyższonym poziomem PSA u 3,293 mężczyzn w wieku 40 lat i starszych, u których nie zdiagnozowano PCa [98]. Zasugerowano, że folian może odgrywać podwójną rolę w karcynogenezie prostaty, a zatem złożony związek między folianem a PCa czeka na dalsze badania [99].
Pomimo potencjalnej roli witaminy C (kwasu askorbinowego) jako przeciwutleniacza w terapii przeciwnowotworowej, niewiele jest badań dotyczących spożycia lub suplementacji witaminy C w diecie. RCT nie wykazało wpływu spożycia witaminy C na ryzyko PCa [89]. Co więcej, witamina C w dużych dawkach może działać bardziej jako prooksydant niż przeciwutleniacz, co komplikuje projekt i interpretację badań.
Pierwotna aktywna forma witaminy D, 1,25-dihydroksywitamina D3 (kalcytriol) pomaga w prawidłowym tworzeniu kości, indukuje różnicowanie niektórych komórek odpornościowych i hamuje szlaki pronowotworowe, takie jak proliferacja i angiogeneza, i sugeruje się, że korzystnie wpływa na ryzyko PCa [100]; jednak ustalenia nadal są niejednoznaczne. Nowsze badania wykazały, że zwiększone poziomy witaminy D w surowicy były związane ze zmniejszonym ryzykiem PCa [101,102]. Ponadto suplementacja witaminy D może spowolnić postęp PCa lub wywołać apoptozę w komórkach PCa [103-105]. Jednak inne badania wykazały brak wpływu suplementacji witaminą D na PSA [106] lub brak wpływu statusu witaminy D na ryzyko PCa [107,108]. W niektórych badaniach stwierdzono, że niższy poziom witaminy D był związany z niższym ryzykiem PCa u starszych mężczyzn [109], a wyższy poziom witaminy D w surowicy był związany z wyższym ryzykiem PCa [110,111]. Badanie sugerowało nawet, że może istnieć związek w kształcie litery „U” między stanem witaminy D a PCa, a optymalny zakres krążącej witaminy D w zapobieganiu PCa może być wąski [112]. Jest to zgodne z ustaleniami dotyczącymi innych składników odżywczych, że większe spożycie korzystnego składnika odżywczego nie zawsze może być lepsze.
Niedawne badanie wykazało, że związek między witaminą D i PCa był modulowany przez białko wiążące witaminę D [113], co mogło częściowo wyjaśniać poprzednie niespójne ustalenia. Ponadto metaanaliza badająca związek między polimorfizmami receptora witaminy D (VDR) (BsmI i FokI) a ryzykiem PCa wykazała brak związku z ryzykiem PCa [114]. Dlatego rola witaminy D w PCa pozostaje niejasna.
W dużym randomizowanym badaniu obejmującym łącznie 14,641 50 amerykańskich lekarzy płci męskiej w wieku powyżej 400 lat, uczestnicy losowo otrzymywali 10.3 jm witaminy E co drugi dzień przez ogólną średnią 13.8 (115) lat. Suplementacja witaminą E nie miała natychmiastowego ani długoterminowego wpływu na ryzyko całkowitego raka lub PCa [50]. Jednak umiarkowana dawka suplementu witaminy E (75 mg lub około 29,133 IU) spowodowała mniejsze ryzyko PCa wśród 116 117 fińskich palących mężczyzn [118,119]. Wiele badań przedklinicznych sugeruje, że witamina E spowalnia wzrost guza, częściowo z powodu hamowania syntezy DNA i indukowania szlaków apoptotycznych [120,121]. Niestety, badania na ludziach były mniej niż wspierające. Dwa badania obserwacyjne (Cancer Prevention Study II Nutrition Cohort oraz NIH-AARP Diet and Health Study) nie wykazały związku między suplementacją witaminy E a ryzykiem PCa [122, 123]. Jednak wyższy poziom a-tokoferolu w surowicy, ale nie poziom a-tokoferolu, wiązał się ze zmniejszonym ryzykiem PCa [124], a związek ten może być modyfikowany przez zmiany genetyczne w genach związanych z witaminą E [1,739]. Wręcz przeciwnie, prospektywne randomizowane badanie, Selenium and Vitamin E Cancer Prevention Trial (SELECT), wykazało, że suplementacja witaminą E znacząco zwiększa ryzyko PCa [3,117] i że wyższy poziom ?-tokoferolu w osoczu może wchodzić w interakcje z suplementami selenu w celu zwiększenia stopnia Ryzyko PCa [125]. To odkrycie jest zgodne z badaniem kohortowym obejmującym XNUMX przypadków i XNUMX kontroli, które wykazały zwiększone ryzyko wystąpienia PCa przez witaminę E wśród osób o niskim statusie selenu, ale nie tych z wysokim statusem selenu [XNUMX]. W związku z tym potrzebne są dalsze badania, aby zbadać związek między witaminą E i PCa oraz należy rozważyć efekt dawki i interakcję z innymi składnikami odżywczymi.
Postawiono hipotezę, że witamina K pomaga zapobiegać PCa poprzez redukcję biodostępnego wapnia. Badania przedkliniczne wykazują, że połączenie witamin C i K wykazuje silne działanie przeciwnowotworowe in vitro i działa jako chemo- i radiosensybilizatory in vivo [126]. Do tej pory zbadano to w niewielu badaniach, chociaż jedno badanie z wykorzystaniem kohorty European Prospective Investigation into Cancer and Nutrition (EPIC)-Heidelberg wykazało odwrotną zależność między przyjmowaniem witaminy K (jako menachinonów) a występowaniem PCa [127]. Przeprowadzono niewiele badań przedklinicznych w celu zbadania roli wapnia w PCa. Retrospektywne i metaanalizy sugerują zwiększone lub zmniejszone ryzyko PCa ze zwiększonym spożyciem wapnia, podczas gdy inne sugerują brak związku [128,129]. Inne badanie sugeruje związek w kształcie litery „U”, w którym bardzo niski poziom wapnia lub suplementacja są związane z PCa [130].
Z drugiej strony wysunięto hipotezę, że selen zapobiega PCa. Podczas gdy badania in vitro sugerowały, że selen hamował angiogenezę i proliferację, jednocześnie indukując apoptozę [131], wyniki z SELECT nie wykazały korzyści z samego selenu lub w połączeniu z witaminą E w chemoprewencji PCa [123]. Co więcej, suplementacja selenu nie przyniosła korzyści mężczyznom z niskim poziomem selenu, ale zwiększyła ryzyko PCa o wysokim stopniu złośliwości wśród mężczyzn z wysokim poziomem selenu w losowo wybranej kohorcie 1,739 przypadków z PCa o wysokim stopniu złośliwości (Gleason 7) i 10 kontroli [ 3,117]. Prospektywne holenderskie badanie kohortowe, w którym wzięło udział 125 58,279 mężczyzn w wieku od 55 do 69 lat, również wykazało, że selen wiązał się ze zmniejszonym ryzykiem zaawansowanego PCa [132]. Potrzebne są dalsze badania, aby wyjaśnić rolę selenu w PCa.
Fitochemicznych
Wraz z witaminami i minerałami [2], rośliny zawierają fitochemikalia o potencjalnym działaniu przeciwnowotworowym. Zazwyczaj nie uważane za niezbędne związki, fitochemikalia mają właściwości przeciwutleniające i przeciwzapalne.
Sylibinina to polifenolowy flawonoid występujący w nasionach ostropestu plamistego. Wykazano, że in vitro i in vivo hamuje wzrost PCa poprzez celowanie w szlaki receptora naskórkowego czynnika wzrostu (EGFR), receptora IGF-1 (IGF-1R) i czynnika jądrowego-kappa B (NF-kB) [133,134]. Ostatnie badania wykazały, że sylibinina może być użyteczna w zapobieganiu PCa poprzez hamowanie ekspresji TGFβ2 i biomarkerów podobnych do fibroblastów związanych z rakiem (CAF) w ludzkich komórkach zrębu prostaty [135]. Tak więc sylibinina jest obiecującym kandydatem na chemoprewencyjny środek PCa, który czeka na dalsze badania.
Kurkumina jest stosowana jako dodatek do żywności w Azji oraz jako lek ziołowy na zapalenie [136]. In vitro kurkumina hamuje prozapalne białko NF-kB, jednocześnie indukując apoptozę poprzez zwiększoną ekspresję genów proapoptotycznych [137]. In vivo kurkumina spowalnia wzrost PCa u myszy, jednocześnie uwrażliwiając nowotwory na chemio- i radioterapię [136]; jednak żadne badanie na ludziach nie zbadało jego wpływu na PCa.
Granat
Skórka i owoce granatów i orzechów włoskich są bogate w elagitaniny (punikalaginy). Te fitochemikalia są łatwo metabolizowane do aktywnej postaci kwasu elagowego przez florę jelitową [138]. Doświadczenia przedkliniczne wykazały, że elagitaniny hamują proliferację PCa i angiogenezę w warunkach hipoksji i indukują apoptozę [137,138, 139,140]. W prospektywnych badaniach u mężczyzn z rosnącym PSA po podstawowym leczeniu, sok z granatów lub POMx, dostępny w handlu ekstrakt z granatów, wydłużył czas podwojenia PSA w stosunku do wartości wyjściowych [141], chociaż żadne badania nie obejmowały grupy placebo. Oczekuje na wyniki z prospektywnego placebo RCT z użyciem ekstraktu z granatu u mężczyzn z rosnącym PSA. Jednak w badaniu kontrolowanym placebo dwie tabletki POMx dziennie przez okres do czterech tygodni przed radykalną prostatektomią nie miały wpływu na patologię guza lub stres oksydacyjny ani na jakiekolwiek inne pomiary guza [XNUMX].
Herbata zielona
Zielona herbata zawiera szereg polifenoli o działaniu przeciwutleniającym, w tym katechiny, takie jak galusan epigallokatechiny (EGCG), epigallokatechina (EGC), (?)-3-galusan epikatechiny (ECG) i (?)-epikatechina. Badania przedkliniczne sugerują, że EGCG hamuje wzrost PCa, indukuje wewnętrzne i zewnętrzne szlaki apoptotyczne oraz zmniejsza stan zapalny poprzez hamowanie NFkB [137]. Ponadto właściwości przeciwutleniające EGCG są 25 do 100 razy silniejsze niż witaminy C i E [131]. W prospektywnym randomizowanym badaniu preprostatektomii mężczyźni spożywający parzoną zieloną herbatę Lin et al. BMC Medicine (2015) 13:3 Strona 7 z 15 przed zabiegiem miała podwyższony poziom polifenoli z zielonej herbaty w tkance prostaty [142]. W małym badaniu dowodowym z 60 mężczyznami dzienna suplementacja 600 mg ekstraktu katechinowego z zielonej herbaty zmniejszyła częstość występowania PCa o 90% (3% w porównaniu z 30% w grupie placebo) [143]. Inne małe badanie wykazało również, że suplementacja EGCG powodowała znaczne zmniejszenie PSA, czynnika wzrostu hepatocytów i czynnika wzrostu śródbłonka naczyniowego u mężczyzn z PCa [144]. Badania te sugerują, że polifenole z zielonej herbaty mogą zmniejszać częstość występowania PCa i zmniejszać progresję PCa, ale potrzebne są dalsze badania, aby potwierdzić i wyjaśnić jego mechanizm [137,143,145].
resweratrol
Podczas gdy większość badań in vitro sugeruje, że resweratrol hamuje wzrost PCa [146-148], resweratrol hamuje wzrost guza w niektórych [137], ale nie we wszystkich modelach zwierzęcych [149], prawdopodobnie z powodu ograniczonej biodostępności [150,151]. Do chwili obecnej nie ma badań klinicznych oceniających zapobiegawcze lub terapeutyczne działanie resweratrolu na PCa.
Zyflamend
Zyflamend to przeciwzapalna mieszanka ziół, która, jak wykazano, zmniejsza progresję PCa poprzez obniżenie ekspresji markerów, w tym pAKT, PSA, deacetylaz histonowych i receptora androgenowego w modelach zwierzęcych i linii komórkowej PCa [152-154]. Pomimo jego potencjału przeciwnowotworowego [155], bardzo niewiele badań przeprowadzono na ludziach [156,157]. W otwartym badaniu fazy I obejmującym 23 pacjentów ze śródnabłonkową neoplazją gruczołu krokowego o wysokim stopniu złośliwości, sam Zyflamend lub w połączeniu z innymi suplementami diety przez 18 miesięcy zmniejszał ryzyko rozwoju PCa [156]. Potrzeba więcej RCT u ludzi, aby potwierdzić skuteczność i kliniczne zastosowanie tego ziołowego suplementu.
Inne produkty pełnoziarniste Owoce i warzywa
Owoce i warzywa są bogatym źródłem witamin, minerałów i fitochemikaliów. Kilka badań epidemiologicznych wykazało odwrotną zależność między całkowitym spożyciem owoców i warzyw [158], a spożyciem warzyw kapustnych i ryzykiem PCa [159,160, 161]. Warzywa Allium, takie jak czosnek, por, szczypiorek i szalotka, zawierają wiele siarkowych fitochemikaliów, które, jak sugerowano, wzmacniają układ odpornościowy, hamują wzrost komórek, modulują ekspresję genów reagujących na androgeny i indukują apoptozę [162]. Chociaż liczba opublikowanych badań jest ograniczona, zarówno dane przedkliniczne, jak i epidemiologiczne sugerują, że spożycie warzyw allium może chronić przed PCa, zwłaszcza chorobą zlokalizowaną [199]. Randomizowane badanie z udziałem 163 mężczyzn wykazało również, że dodatek mieszanki granatu, zielonej herbaty, brokułów i kurkumy znacznie zmniejszył tempo wzrostu PSA u mężczyzn z PCa [XNUMX].
Pomidory i produkty z pomidorów
W wielu badaniach zbadano związek między pomidorami i produktami z pomidorów a PCa, ale wyniki są niejednoznaczne. Antyoksydacyjny likopen, który jest bogaty w pomidory, również został przebadany pod kątem jego wpływu na PCa. In vitro likopen zatrzymuje cykl komórkowy w kilku liniach komórkowych PCa i zmniejsza sygnalizację IGF-1 poprzez indukcję białek wiążących IGF-1 [131]. Podczas gdy niektóre badania na zwierzętach wykazały, że likopen specyficznie spowalnia wzrost PCa [164] lub redukuje komórki nabłonkowe PCa na etapach inicjacji, promocji i progresji [165], dwa badania wykazały sprzeczne wyniki między pastą pomidorową a likopenem [166,167]. Prospektywne badania na ludziach wykazały, że większe spożycie likopenu [168,169] lub wyższe poziomy w surowicy były związane z niższym ryzykiem PCa [170], ale inne nie [171,172]. Stężenie likopenu gruczołu krokowego poniżej progu 1 ng/mg było związane z PCa w biopsji kontrolnej po sześciu miesiącach (p = 0.003) [173]. Dwa krótkoterminowe badania przed prostatektomią z użyciem sosu pomidorowego lub suplementacji likopenem wykazały wychwyt likopenu w tkance prostaty oraz działanie przeciwutleniające i potencjalne przeciwnowotworowe [174,175]. Podczas gdy kilka badań klinicznych sugerowało odwrotną zależność między suplementacją likopenu, poziomem PSA i zmniejszeniem objawów związanych z rakiem [171,176], żadne randomizowane badania na dużą skalę nie sprawdzały roli likopenu lub produktów pomidorowych w zapobieganiu lub leczeniu PCa.
Kawa
Kawa zawiera kofeinę i kilka niezidentyfikowanych związków fenolowych, które mogą służyć jako przeciwutleniacze. Badania epidemiologiczne sugerują odwrotną zależność między spożyciem kawy a ryzykiem PCa, głównie w zaawansowanym lub śmiertelnym stadium choroby, a wyniki były niezależne od zawartości kofeiny [177,178, 179]. Chociaż kilka badań epidemiologicznych [182-183] nie wykazało związku między spożyciem kawy a ryzykiem PCa, niedawna metaanaliza badań prospektywnych wykazała, że spożywanie kawy może zmniejszać ryzyko PCa [XNUMX]. Potencjalne mechanizmy i szlaki są nieznane, ale mogą obejmować działanie przeciwutleniające, przeciwzapalne, metabolizm glukozy i insuliny oraz potencjalny wpływ na IGF-I i krążące hormony płciowe.
Wzorce dietetyczne
Chociaż zbadano wiele pojedynczych składników odżywczych lub czynników pokarmowych pod kątem ich wpływu lub związku z ryzykiem lub progresją PCa, wyniki były w dużej mierze niejednoznaczne. Potencjalną przyczyną niezgodności jest fakt, że wpływ pojedynczego składnika odżywczego lub czynnika pokarmowego może być zbyt mały, aby mógł zostać wykryty. Ponadto składniki odżywcze naturalnie występujące w żywności są często silnie skorelowane i mogą ze sobą oddziaływać, a tym samym wpływać na wpływ na PCa. Tak więc, analiza wzorców żywieniowych otrzymywała coraz więcej Lin et al. BMC Medicine (2015) 13:3 Strona 8 z 15 , ale badania były ograniczone, a dotychczasowe wyniki były niejednoznaczne. W kohorcie 293,464 70 mężczyzn wysoka jakość diety, na co wskazuje wynik HEI, wiązała się z niższym ryzykiem całkowitego ryzyka PCa [XNUMX]. W celu zapobiegania choroby układu krążenia i otyłości [184] i mogą być obiecujące w zapobieganiu PCa [185]. Spożycie ryb i kwasów tłuszczowych omega-3 we wzorcu śródziemnomorskim było znacząco i odwrotnie związane z ryzykiem śmiertelnego PCa. Ponadto przestrzeganie diety śródziemnomorskiej po rozpoznaniu PCa bez przerzutów wiązało się z niższą ogólną śmiertelnością [186]. Natomiast model zachodni z wysokim spożyciem czerwonego mięsa, przetworów mięsnych, smażonych ryb, frytek, odtłuszczonego mleka i białego pieczywa wiązał się z wyższym ryzykiem wystąpienia PCa [187].
Co więcej, kraje azjatyckie o wysokim spożyciu WNKT omega-3, fitochemikaliów opartych na soi i zielonej herbacie, mają mniejszą częstość występowania PCa w porównaniu z krajami stosującymi dietę „w stylu zachodnim” [188]. Jednak nie wszystkie badania [189-191] potwierdziły związek między pewnym wzorcem żywieniowym a ryzykiem PCa. Możliwe, że metodologia zastosowana do identyfikacji wzorców żywieniowych mogła nie obejmować wszystkich czynników żywieniowych związanych z ryzykiem PCa. Alternatywnie, każdy wzorzec żywieniowy może zawierać zarówno korzystne, jak i szkodliwe składniki, co skutkuje całkowitym zerowym powiązaniem. Potrzebne są dalsze badania, aby kontynuować poszukiwania wzorców żywieniowych, które łączą większość korzystnych składników odżywczych/czynników pokarmowych dla PCa i ograniczają większość negatywnych składników odżywczych/czynników pokarmowych.
Przyszły kierunek badań klinicznych
W oparciu o liczne badania epidemiologiczne, przedkliniczne i kliniczne opisane w tym przeglądzie, interwencje dietetyczne w zapobieganiu i leczeniu PCa są bardzo obiecujące. Ponadto, kilka czynników dietetycznych i witamin/suplementów może być związanych z ryzykiem PCa i/lub progresją choroby. Prospektywne randomizowane badania są wyraźnie wskazane w celu zidentyfikowania określonych składników odżywczych lub terapii skojarzonych w zapobieganiu i leczeniu PCa.
Ostatnio aktywny nadzór (AS) okazał się realną opcją dla mężczyzn z niższym ryzykiem PCa. Mężczyźni z ZA są zmotywowani do przestrzegania zmian w diecie i stylu życia [192], co czyni ten podzbiór dobrym celem interwencji żywieniowych i prób jakości życia [193]. Osoby, które przeżyły PCa, które są bardziej aktywne i zgłaszają „zdrowe” nawyki żywieniowe (to znaczy spożywanie niskotłuszczowych, niskorafinowanych diet węglowodanowych, bogatych w owoce i warzywa) mają lepszą ogólną jakość życia niż ich nieaktywni, niezdrowi odpowiednicy [194]. W związku z tym uzasadnione jest przeprowadzenie większej liczby badań z randomizacją w celu określenia ogólnych długoterminowych skutków interwencji dietetycznej w tej populacji. W szczególności kluczowe pytania, na które należy odpowiedzieć w przyszłych badaniach, to: 1) Czy interwencje dietetyczne mogą opóźnić konieczność leczenia u mężczyzn z ZA; 2) Czy interwencje dietetyczne mogą zapobiegać nawrotom u mężczyzn po leczeniu; 3) Czy interwencje dietetyczne mogą opóźnić progresję u mężczyzn z nawrotami choroby, a tym samym opóźnić potrzebę terapii hormonalnej; 4) Czy interwencje dietetyczne mogą zmniejszyć skutki uboczne leczenia PCa, w tym terapii hormonalnej i nowszych terapii celowanych; oraz 5) Czy interwencje dietetyczne same lub w połączeniu z terapią celowaną u mężczyzn stosujących terapię hormonalną mają jakąkolwiek rolę w zapobieganiu oporności na kastrację lub po pojawieniu się oporności na kastrację? Ponieważ coraz więcej dowodów wskazuje, że nieprawidłowości metaboliczne zwiększają ryzyko wystąpienia PCa, interwencja w zakresie stylu życia, która poprawia profil metaboliczny, jest korzystną opcją w zapobieganiu i leczeniu PCa [195,196].
Wnioski: rak prostaty
Konieczne są dalsze badania, aby określić idealną dietę do zapobiegania lub leczenia PCa. Jednak kilka czynników żywieniowych i niektóre wzorce żywieniowe obiecują zmniejszenie ryzyka PCa lub progresji i są zgodne z aktualnymi wytycznymi żywieniowymi dla Amerykanów [197]. W przypadku poradnictwa dla pacjentów na temat diety w celu zapobiegania pierwotnej i wtórnej PCa, wielu uważa, że „zdrowe serce to zdrowa prostata”. Tak więc, biorąc pod uwagę obecne niejednoznaczne wyniki, najlepsze porady dietetyczne w zapobieganiu lub leczeniu PCa wydają się obejmować: zwiększenie ilości owoców i warzyw, zastąpienie rafinowanych węglowodany z pełnymi ziarnami, redukcja tłuszczów całkowitych i nasyconych, redukcja rozgotowanych mięs i spożywanie umiarkowanej ilości kalorii lub redukcja węglowodanów, której głównym celem jest uzyskanie i utrzymanie zdrowej masy ciała.
Konkurujące interesy Autorzy deklarują brak sprzecznych interesów.
Wkład autorów P-HL i SF przeprowadziły recenzję, P-HL przygotowały szkic manuskryptu, a SF i WA zredagowały i wniosły krytyczny wkład. Wszyscy autorzy przeczytali i zatwierdzili ostateczny rękopis.
Podziękowania Dofinansowanie pochodziło z grantów 1K24CA160653 (Freedland), NIH P50CA92131 (W. Aronson). Ten rękopis jest wynikiem pracy wspartej zasobami i wykorzystaniem obiektów w Veterans Administration Medical Center w West Los Angeles (W. Aronson).
Dane autora 1 Department of Medicine, Division of Nefrology, Duke University Medical Center, Box 3487, Durham, NC 27710, USA. 2 Sekcja Urologii, Oddział Chirurgii, Veterans Affairs Greater Los Angeles Healthcare System, Los Angeles, CA, USA. 3 Department of Urology, UCLA School of Medicine, Los Angeles, CA, USA. 4 Sekcja Urologii, Oddział Chirurgii, Durham Veterans Affairs Medical Center, Oddział Urologii, Durham, NC, USA. 5 Duke Prostate Center, Departments of Surgery and Pathology, Duke University Medical Center, Durham, NC, USA.
pusty
Referencje:
1. Centrum MM, Jemal A, Lortet-Tieulent J, Oddział E, Ferlay J, Brawley O, Bray F:
Międzynarodowe zróżnicowanie wskaźników zachorowalności i śmiertelności na raka prostaty.
Eur Urol 2012, 61:1079-1092.
2. Masko EM, Allott EH, Freedland SJ: Związek między odżywianiem a
rak prostaty: czy więcej zawsze jest lepsze? Eur Urol 2013, 63:810.
3. Mavropoulos JC, Isaacs WB, Pizzo SV, Freedland SJ: Czy jest rola dla
niskowęglowodanowa dieta ketogeniczna w leczeniu raka prostaty?
Urologia 2006, 68:15-18.
4. Freedland SJ, Mavropoulos J, Wang A, Darshan M, Demark-Wahnefried W,
Aronson WJ, Cohen P, Hwang D, Peterson B, Fields T, Pizzo SV, Isaacs WB:
Ograniczenie węglowodanów, wzrost raka prostaty i insulinopodobny
oś czynnika wzrostu. Prostata 2008, 68:11.
5. Mavropoulos JC: Buschemeyer WC 3., Tewari AK, Rokhfeld D, Pollak M,
Zhao Y, Febbo PG, Cohen P, Hwang D, Devi G, Demark-Wahnefried W,
Westman EC, Peterson BL, Pizzo SV, Freedland SJ: Efekty różnicowania
zawartość węglowodanów i tłuszczu w diecie na przeżycie u myszy LNCaP
model heteroprzeszczepu raka prostaty. Rak Poprzednia Res (Phila Pa) 2009,
2: 557 565.
6. Masko EM, Thomas JA 2., Antonelli JA, Lloyd JC, Phillips TE, Poulton SH,
Dewhirst MW, Pizzo SV, Freedland SJ: Diety niskowęglowodanowe i
rak prostaty: jak niski jest „wystarczająco niski”? Rak Poprzednia Res (Fila) 2010,
3: 1124 1131.
7. Drake I, Sonestedt E, Gullberg B, Ahlgren G, Bjartell A, Wallstrom P, Wirfült E:
Spożycie węglowodanów w diecie a ryzyko raka prostaty: a
prospektywne badanie w kohorcie Malmo Diet and Cancer. Jestem J Clin Nutr
2012, 96:1409-1418.
8. Zhang J, Shen C, Wang L, Ma Q, Xia P, Qi M, Yang M, Han B: Metformina
hamuje przemianę nabłonkowo-mezenchymalną w komórkach raka prostaty:
Zaangażowanie supresora guza miR30a i jego docelowego genu SOX4.
Biochem Biophys Res Commun 2014, 452:746.
9. Lee SY, Song CH, Xie YB, Jung C, Choi HS, Lee K: SMILE podwyższony przez
metformina hamuje funkcję receptora androgenowego w raku prostaty
komórki. Rak Lett 2014, 354:390.
10. Demir U, Koehler A, Schneider R, Schweiger S, Klocker H: Metformina przeciwnowotworowa
efekt poprzez zakłócenie translacyjnego kompleksu regulatora MID1
i obniżenie poziomu AR w komórkach raka prostaty. BMC Rak 2014, 14:52.
11. Margel D: Metformina w zapobieganiu rakowi prostaty: wezwanie do zjednoczenia. Eur Urol
2014. doi:10.1016/j.eururo.2014.05.012. [Epub z wyprzedzeniem]
12. Margel D, Urbach DR, Lipscombe LL, Bell CM, Kulkarni G, Austin PC, Fleshner
N: Stosowanie metforminy i śmiertelność z jakiejkolwiek przyczyny i raka prostaty
wśród mężczyzn z cukrzycą. J Clin Oncol 2013, 31:3069.
13. Tseng CH: Metformina znacznie zmniejsza ryzyko wystąpienia raka prostaty
u tajwańskich mężczyzn z cukrzycą typu 2. Eur J Rak 2014,
50: 2831 2837.
14. Joshua AM, Zannella VE, Downes MR, Bowes B, Hersey K, Koritzinsky M,
Schwab M, Hofmann U, Evans A, van der Kwast T, Trachtenberg J, Finelli A,
Fleshner N, Sweet J, Pollak M: Pilotażowe „okno możliwości”
badanie neoadiuwantowe metforminy w zlokalizowanym raku prostaty. Prostata
Rak Prostatic Dis 2014, 17:252 258.
15. Rothermundt C, Hayoz S, Templeton AJ, Winterhalder R, Strebel RT, Bartschi
D, Pollak M, Lui L, Endt K, Schiess R, Räschoff JH, Cathomas R, Gillessen S:
Metformina w opornym na kastrację raku prostaty, u którego wcześniej nie stosowano chemioterapii:
Wieloośrodkowe badanie fazy 2 (SAKK 08/09). Eur Urol 2014, 66:468.
16. Allott EH, Abern MR, Gerber L, Keto CJ, Aronson WJ, Terris MK, Kane CJ,
Amling CL, Cooperberg MR, Moorman PG, Freedland SJ: Metformina nie
nie wpływa na ryzyko nawrotu biochemicznego po radykalnym
prostatektomia: wyniki z bazy danych SEARCH. Rak prostaty
Prostatic Dis 2013, 16:391.
17. Rieken M, Kluth LA, Xylinas E, Fajkovic H, Becker A, Karakiewicz PI, Herman
M, Lotan Y, Seitz C, Schramek P, Remzi M, Loidl W, Pummer K, Lee RK,
Faison T, Scherr DS, Kautzky-Willer A, Bachmann A, Tewari A, Shariat SF:
Powiązanie cukrzycy i stosowania metforminy z biochemikaliami
nawrót u pacjentów poddanych radykalnej prostatektomii z powodu prostaty
nowotwór. Świat J Urol 2014, 32:999.
18. Margel D, Urbach D, Lipscombe LL, Bell CM, Kulkarni G, Austin PC, Fleshner
N: Związek między stosowaniem metforminy a ryzykiem raka prostaty i
jego ocena. J Natl Cancer Inst 2013, 105:1123.
19. Franciosi M, Lucisano G, Lapice E, Strippoli GF, Pellegrini F, Nicolucci A:
Terapia metforminą a ryzyko zachorowania na raka u pacjentów z cukrzycą typu 2:
przegląd systematyczny. PLoS One 2013, 8:e71583.
20. Kaushik D, Karnes RJ, Eisenberg MS, Rangel LJ, Carlson RE, Bergstralh EJ:
Wpływ metforminy na wyniki raka prostaty po radykalnym
prostatektomia. Urol Oncol 2014, 32:43 e41.
21. Bensimon L, Yin H, Suissa S, Pollak MN, Azoulay L: Zastosowanie metforminy w
pacjentów z rakiem prostaty i ryzykiem zgonu. Epidemiol raka
Biomarkery Poprzednia 2014, 23:2111.
22. Tsilidis KK, Capothanassi D, Allen NE, Rizos EC, Lopez DS, van Veldhoven K,
Sacerdote C, Ashby D, Vineis P, Tzoulaki I, Ioannidis JP: Metformina nie
wpływają na ryzyko zachorowania na raka: badanie kohortowe w Wielkiej Brytanii Badania Praktyki Klinicznej
Datalink analizowany jak próba z zamiarem leczenia. Opieka diabetologiczna 2014,
37: 2522 2532.
23. Levine ME, Suarez JA, Brandhorst S, Balasubramanian P, Cheng CW, Madia F,
Fontana L, Mirisola MG, Guevara-Aguirre J, Wan J, Passarino G, Kennedy BK,
Wei M, Cohen P, Crimmins EM, Longo VD: Niskie spożycie białka jest związane
z poważnym zmniejszeniem IGF-1, raka i ogólnej śmiertelności w 65
i młodsza, ale nie starsza populacja. Metab komórki 2014, 19:407.
24. Solon-Biet SM, McMahon AC, Ballard JW, Ruohonen K, Wu LE, Cogger VC,
Warren A, Huang X, Pichaud N, Melvin RG, Gokarn R, Khalil M, Turner N,
Cooney GJ, Sinclair DA, Raubenheimer D, Le Couteur DG, Simpson SJ:
stosunek makroskładników, a nie spożycie kalorii, dyktuje kardiometaboliczne
zdrowie, starzenie się i długowieczność u myszy karmionych ad libitum. Metab Komórkowy 2014,
19: 418 430.
25. Richman EL, Stampfer MJ, Paciorek A, Broering JM, Carroll PR, Chan JM:
Spożycie mięsa, ryb, drobiu i jaj a ryzyko raka prostaty
postęp. Am J Clin Nutr 2010, 91:712.
26. Joshi AD, John EM, Koo J, Ingles SA, Stern MC: Spożywanie ryb, gotowanie
praktyki i ryzyko raka prostaty: wynika z wieloetnicznego
studium przypadku i kontroli. Kontrola przyczyn raka 2012, 23:405.
27. Joshi AD, Corral R, Catsburg C, Lewinger JP, Koo J, John EM, Ingles SA,
Stern MC: czerwone mięso i drób, praktyki kulinarne, podatność genetyczna
i ryzyko raka prostaty: wynika z wieloetnicznego przypadku�kontroli
badanie. Karcynogeneza 2012, 33:2108.
28. Catsburg C, Joshi AD, Corral R, Lewinger JP, Koo J, John EM, Ingles SA,
Stern MC: Polimorfizmy w enzymach metabolizmu kancerogenów, ryby
spożycie i ryzyko raka prostaty. Karcynogeneza 2012, 33:1352.
29. Pettersson A, Kasperzyk JL, Kenfield SA, Richman EL, Chan JM, Willett WC,
Stampfer MJ, Mucci LA, Giovannucci EL: Spożycie mleka i nabiału
wśród mężczyzn z rakiem prostaty i ryzykiem przerzutów i prostaty
śmierć z powodu raka. Biomarkery epidemii raka Poprzedni 2012, 21:428.
30. Deneo-Pellegrini H, Ronco AL, De Stefani E, Boffetta P, Correa P,
Mendilaharsu M, Acosta G: Grupy żywności i ryzyko raka prostaty: a
badanie kliniczno-kontrolne w Urugwaju. Kontrola przyczyn raka 2012, 23:1031-1038.
31. Park SY, Murphy SP, Wilkens LR, Stram DO, Henderson BE, Kolonel LN:
Spożycie wapnia, witaminy D i produktów mlecznych oraz ryzyko raka prostaty:
wieloetniczne badanie kohortowe. Am J Epidemiol 2007, 166:1259.
32. Song Y, Chavarro JE, Cao Y, Qiu W, Mucci L, Sesso HD, Stampfer MJ,
Giovannucci E, Pollak M, Liu S, Ma J: Spożycie pełnego mleka jest związane z
Śmiertelność związana z rakiem prostaty wśród amerykańskich lekarzy płci męskiej. J Nutr luty
2013, 143:189-196.
33. Młody NJ, Metcalfe C, Gunnell D, Rowlands MA, Lane JA, Gilbert R, Avery
KN, Davis M, Neal DE, Hamdy FC, Donovan J, Martin RM, Holly JM: przekrój poprzeczny
analiza związku między dietą a wzrostem insulinopodobnym
czynnika (IGF)-I, IGF-II, białka wiążącego IGF (IGFBP)-2 i IGFBP-3 u mężczyzn w
Wielka Brytania. Kontrola przyczyn raka 2012, 23:907.
34. Christensen MJ, Quiner TE, Nakken HL, Lephart ED, Eggett DL, Urie PM:
Połączone działanie soi w diecie i metyloselenocysteiny u myszy
model raka prostaty. Prostata 2013, 73:986.
35. Bosland MC, Kato I, Zeleniuch-Jacquotte A, Schmoll J, Enk Rueter E,
Melamed J, Kong MX, Macias V, Kajdacsy-Balla A, Lumey LH, Xie H, Gao W,
Walden P, Lepor H, Taneja SS, Randolph C, Schlicht MJ, Meserve-Watanabe
H, Deaton RJ, Davies JA: Wpływ suplementacji izolatu białka sojowego na
biochemiczny nawrót raka prostaty po radykalnej prostatektomii: a
próba losowa. JAMA 2013, 310:170.
36. Chiyomaru T, Yamamura S, Fukuhara S, Yoshino H, Kinoshita T, Majid S, Saini
S, Chang I, Tanaka Y, Enokida H, Seki N, Nakagawa M, Dahiya R: Genistein
hamuje wzrost komórek raka prostaty poprzez celowanie w miR-34a i onkogenne
GORĄCE POWIETRZE. PLoS One 2013, 8:e70372.
37. Zhang S, Wang Y, Chen Z, Kim S, Iqbal S, Chi A, Ritenour C, Wang YA, Kucuk
O, Wu D: Genisteina zwiększa skuteczność chemioterapii kabazytakselem
w przerzutowych komórkach raka prostaty opornych na kastrację. Prostata 2013,
73:1681-1689.38. van Die MD, Bone KM, Williams SG, Pirotta MV: Soja i izoflawony sojowe w
rak prostaty: przegląd systematyczny i metaanaliza randomizowanych
kontrolowane próby. BJU Int 2014, 113:E119.E130.
39. Hamilton-Reeves JM, Banerjee S, Banerjee SK, Holzbeierlein JM, Thrasher JB,
Kambhampati S, Keighley J, Van Veldhuizen P: krótkoterminowy izoflawon sojowy
interwencja u pacjentów ze zlokalizowanym rakiem prostaty: randomizowana,
podwójnie ślepa, kontrolowana placebo próba. PLoS One 2013, 8:e68331.
40. Pavese JM, Krishna SN, Bergan RC: Genisteina hamuje ludzką prostatę
odwarstwienie, inwazja i przerzuty komórek rakowych. Jestem J Clin Nutr 2014,
100:431S-436S.
41. Gonzalez-Menendez P, Hevia D, Rodriguez-Garcia A, Mayo JC, Sainz RM:
Regulacja transporterów GLUT przez flawonoidy u wrażliwych na androgeny i
-niewrażliwe komórki raka prostaty. Endokrynologia 2014, 155:3238.
42. Hirata H, Hinoda Y, Shahryari V, Deng G, Tanaka Y, Tabatabai ZL, Dahiya R:
Genisteina obniża poziom onco-miR-1260b i podwyższa poziom sFRP1 i
Smad4 poprzez demetylację i modyfikację histonów w raku prostaty
komórki. Br J Cancer 2014, 110:1645.
43. Handayani R, Rice L, Cui Y, Medrano TA, Samedi VG, Baker HV, Szabo NJ,
Shiverick KT: Izoflawony sojowe zmieniają ekspresję genów związanych z
progresja raka, w tym interleukina-8, u osób niezależnych od androgenów
Komórki ludzkiego raka prostaty PC-3. J Nutr 2006, 136:75.
44. Travis RC, Allen NE, Appleby PN, Cena A, Kaaks R, Chang-Claude J, Boeing H,
Aleksandrova K, Tjönneland A, Johnsen NF, Overvad K, Ram�n Quir�s J,
Gonzìlez CA, Molina-Montes E, Sìnchez MJ, Larraùaga N, Castaño JM,
Ardanaz E, Khaw KT, Wareham N, Trichopoulou A, Karapetyan T, Rafnsson
SB, Palli D, Krogh V, Tumino R, Vineis P, Bueno-de-Mesquita HB, Stattin P,
Johansson M i wsp.: Stężenia przeddiagnostyczne genisteiny w osoczu i
ryzyko raka prostaty u 1,605 mężczyzn z rakiem prostaty i 1,697
dopasowani uczestnicy kontroli w EPIC. Kontrola przyczyn raka 2012,
23: 1163 1171.
45. Jackson MD, McFarlane-Anderson ND, Simon GA, Bennett FI, Walker SP:
Fitoestrogeny w moczu a ryzyko raka prostaty u mężczyzn z Jamajki.
Kontrola przyczyn raka 2010, 21:2249-2257.
46. Lazarevic B, Hammarstr.m C, Yang J, Ramberg H, Diep LM, Karlsen SJ,
Kucuk O, Saatcioglu F, Task�n KA, Svindland A: Efekty krótkoterminowych
interwencja genisteiny na ekspresję biomarkera prostaty u pacjentów z:
zlokalizowany rak prostaty przed radykalną prostatektomią. Br J Nutr 2012,
108: 2138 2147.
47. Epstein MM, Kasperzyk JL, Mucci LA, Giovannucci E, Cena A, Wolk A,
H�kansson N, Fall K, Andersson SO, Andr�n O: Spożycie kwasów tłuszczowych w diecie i
przeżycie raka prostaty w hrabstwie Orebro w Szwecji. Am J Epidemiol 2012,
176: 240 252.
48. Kobayashi N, Barnard RJ, Said J, Hong-Gonzalez J, Corman DM, Ku M,
Doan NB, Gui D, Elashoff D, Cohen P, Aronson WJ: Wpływ diety niskotłuszczowej na
rozwój raka prostaty i fosforylacja Akt w Hi-Myc
transgeniczny model myszy. Cancer Res 2008, 68:3066.
49. Ngo TH, Barnard RJ, Cohen P, Freedland S, Tran C, deGregorio F, Elshimali
YI, Heber D, Aronson WJ: Wpływ izokalorycznej diety niskotłuszczowej na człowieka
Ksenoprzeszczepy raka prostaty LAPC-4 w ciężkim złożonym niedoborze odporności
myszy i oś insulinopodobnego czynnika wzrostu. Clin Cancer Res 2003,
9: 2734 2743.
50. Huang M, Narita S, Numakura K, Tsuruta H, Saito M, Inoue T, Horikawa Y,
Tsuchiya N, Habuchi T: Dieta wysokotłuszczowa zwiększa proliferację
komórek raka prostaty i aktywuje sygnalizację MCP-1/CCR2. Prostata 2012,
72: 1779 1788.
51. Chang SN, Han J, Abdelkader TS, Kim TH, Lee JM, Song J, Kim KS, Park JH,
Park JH: Wysokie spożycie tłuszczów zwierzęcych przyspiesza progresję raka prostaty
i zmniejsza ekspresję peroksydazy glutationowej 3 we wczesnych stadiach
Myszy TRAMP. Prostata 2014, 74:1266.
52. Bidoli E, Talamini R, Bosetti C, Negri E, Maruzzi D, Montella M, Franceschi S,
La Vecchia C: makroskładniki odżywcze, kwasy tłuszczowe, cholesterol i rak prostaty
ryzyko. Ann Oncol 2005, 16:152.
53. Park SY, Murphy SP, Wilkens LR, Henderson BE, Kolonel LN: Tłuszcz i mięso
spożycie i ryzyko raka prostaty: wieloetniczne badanie kohortowe. Int J Rak
2007, 121:1339-1345.
54. Wallstrom P, Bjartell A, Gullberg B, Olsson H, Wirfalt E: Badanie prospektywne
na tłuszcz w diecie i zachorowalność na raka prostaty (Malmo, Szwecja).
Kontrola przyczyn raka 2007, 18:1107-1121.
55. Crowe FL, Key TJ, Appleby PN, Travis RC, Overvad K, Jakobsen MU,
Johnsen NF, Tjänneland A, Linseisen J, Rohrmann S, Boeing H, Pischon T,
Trichopoulou A, Lagiou P, Trichopoulos D, Sacerdote C, Palli D, Tumino R,
Krogh V, Bueno-de-Mesquita HB, Kiemeney LA, Chirlaque MD, Ardanaz E,
Snchez MJ, Larra�aga N, Gonz�lez CA, Quir�s JR, Manjer J, Wirf�lt E, Stattin
P i wsp: Spożycie tłuszczu w diecie i ryzyko raka prostaty w Europie
Prospektywne badanie raka i odżywiania. Jestem J Clin Nutr 2008,
87: 1405 1413.
56. Ohwaki K, Endo F, Kachi Y, Hattori K, Muraishi O, Nishikitani M, Yano E:
Związek między czynnikami dietetycznymi a antygenem specyficznym dla prostaty w
zdrowych mężczyzn. Urol Int 2012, 89:270.
57. Bassett JK, Severi G, Hodge AM, MacInnis RJ, Gibson RA, Hopper JL,
angielski DR, Giles GG: fosfolipidowe kwasy tłuszczowe w osoczu, dietetyczne kwasy tłuszczowe
i ryzyko raka prostaty. Int J Cancer 2013, 133:1882-1891.
58. Richman EL, Kenfield SA, Chavarro JE, Stampfer MJ, Giovannucci EL, Willett
WC, Chan JM: Spożycie tłuszczu po rozpoznaniu i ryzyko śmiertelnego raka prostaty
i śmiertelność z jakiejkolwiek przyczyny. JAMA Intern Med 2013, 173:1318.
59. Williams CD, Whitley BM, Hoyo C, Grant DJ, Iraggi JD, Newman KA, Gerber
L, Taylor LA, McKeever MG, Freedland SJ: Wysoki stosunek dietetycznych kwasów n-6/n-3
wielonienasycone kwasy tłuszczowe wiążą się ze zwiększonym ryzykiem prostaty
nowotwór. Nutr Res 2011, 31:1.
60. Chua ME, Sio MC, Sorongon MC, Dy JS: Związek spożycia z dietą
kwasy tłuszczowe omega-3 i omega-6 z ryzykiem raka prostaty
opracowanie: metaanaliza badań prospektywnych i przegląd
literatura. Rak prostaty 2012, 2012:826254.
61. Berquin IM, Edwards IJ, Kridel SJ, Chen YQ: Wielonienasycone kwasy tłuszczowe
metabolizm w raku prostaty. Przerzuty raka Rev 2011, 30:295.
62. Aronson WJ, Kobayashi N, Barnard RJ, Henning S, Huang M, Jardack PM, Liu
B, Szary A, Wan J, Konijeti R, Freedland SJ, Kółko B, Heber D, Elashoff D, Said
J, Cohen P, Galet C: Faza II prospektywne randomizowane badanie diety niskotłuszczowej
z suplementacją oleju rybiego u mężczyzn poddawanych radykalnej prostatektomii.
Rak Poprzednia Res (Fila) 2011, 4:2062-2071.
63. Hughes-Fulford M, Li CF, Boonyaratanakornkit J, Sayyah S: kwas arachidonowy
aktywuje sygnalizację 3-kinazy fosfatydyloinozytolu i indukuje gen
ekspresja w raku prostaty. Cancer Res 2006, 66:1427.
64. Moreel X, Allaire J, Leger C, Caron A, Labonte ME, Lamarche B, Julien P,
Desmeules P, T�tu B, Fradet V: Kwasy tłuszczowe omega-3 prostaty i dietetyczne
i progresję raka prostaty podczas aktywnego nadzoru. Rak Poprzednia
Res (Fila) 2014, 7:766.
65. Spencer L, Mann C, Metcalfe M, Webb M, Pollard C, Spencer D, Berry D,
Steward W, Dennison A: Wpływ kwasów tłuszczowych omega-3 na angiogenezę guza
i ich potencjał terapeutyczny. Eur J Cancer 2009, 45:2077-2086.
66. Gu Z, Suburu J, Chen H, Chen YQ: Mechanizmy wielonienasyconych kwasów omega-3
kwasy tłuszczowe w profilaktyce raka prostaty. Biomed Res Int 2013, 2013:824563.
67. Lloyd JC, Masko EM, Wu C, Keenan MM, Pilla DM, Aronson WJ, Chi JT,
Freedland SJ: Olej rybi spowalnia wzrost heteroprzeszczepu raka prostaty w stosunku do
inne tłuszcze w diecie i wiąże się ze zmniejszeniem mitochondriów i
ekspresja genów szlaku insuliny. Rak Prostaty Dis 2013,
16: 285 291.
68. Williams CM, Burdge G: Długołańcuchowe PUFA n-3: rośliny kontra źródła morskie.
Proc Nutr Soc 2006, 65:42.
69. Galet C, Gollapudi K, Stepanian S, Byrd JB, Henning SM, Grogan T, Elashoff
D, Heber D, Said J, Cohen P, Aronson WJ: Wpływ niskotłuszczowej diety na olej rybny
na prozapalne eikozanoidy i wskaźnik progresji cyklu komórkowego w
mężczyźni poddawani radykalnej prostatektomii. Rak Poprzednia Res (Fila) 2014,
7: 97 104.
70. Bosire C, Stampfer MJ, Subar AF, Park Y, Kirkpatrick SI, Chiuve SE, Hollenbeck
AR, Reedy J: Wzorce żywieniowe oparte na wskaźnikach a ryzyko raka prostaty
w badaniu diety i zdrowia NIH-AARP. Am J Epidemiol 2013, 177:504.
71. Aronson WJ, Barnard RJ, Freedland SJ, Henning S, Elashoff D, Jardack PM,
Cohen P, Heber D, Kobayashi N: Efekt hamujący wzrost diety niskotłuszczowej
na komórkach raka prostaty: wyniki prospektywnej, randomizowanej diety
badanie interwencyjne u mężczyzn z rakiem prostaty. J Uroł 2010, 183:345.
72. Brouwer IA, Geleijnse JM, Klaasen VM, Smit LA, Giltay EJ, de Goede J,
Heijboer AC, Kromhout D, Katan MB: Wpływ kwasu alfa-linolenowego
suplementacja antygenu specyficznego dla prostaty surowicy (PSA): wyniki z
próba alfa omega. PLoS One 2013, 8:e81519.
73. Chua ME, Sio MC, Sorongon MC, Morales ML Jr: Znaczenie surowicy
poziom długołańcuchowych wielonienasyconych kwasów tłuszczowych omega-3 i prostaty
ryzyko raka: metaanaliza. Czy Urol Assoc J 2013, 7:E333�E343.
74. Yue S, Li J, Lee SY, Lee HJ, Shao T, piosenka B, Cheng L, Masterson TA, Liu X,
Ratliff TL, Cheng JX: akumulacja estru cholesterolu wywołana utratą PTEN
a aktywacja PI3K/AKT leży u podstaw ludzkiego raka prostaty
agresywność. Metab komórki 2014, 19:393.
75. Sun Y, Sukumaran P, Varma A, Derry S, Sahmoun AE, Singh BB: indukowany cholesterolem
aktywacja TRPM7 reguluje proliferację komórek, migrację,
i żywotność ludzkich komórek prostaty. Biochim Biophys Acta 1843,
2014: 1839 1850.
76. Murai T: Obniżenie poziomu cholesterolu: rola w profilaktyce i leczeniu raka.
Biol Chem 2014. doi:10.1515/hsz-2014-0194. [Epub z wyprzedzeniem]
77. Zhuang L, Kim J, Adam RM, Solomon KR, Freeman MR: Cholesterol
celowanie zmienia skład tratwy lipidowej i przeżycie komórek w raku prostaty
komórki i ksenografty. J Clin Invest 2005, 115:959.
78. Mostaghel EA, Solomon KR, Pelton K, Freeman MR, Montgomery RB:
Wpływ poziomu krążącego cholesterolu na wzrost i wewnątrz guza
stężenie androgenów w guzach prostaty. PLoS One 2012,
7: e30062.
79. Morote J, Celma A, Planas J, Placer J, de Torres I, Olivan M, Carles J,
Revent’s J, Doll A: Rola cholesterolu w surowicy i stosowania statyn w ryzyku
wykrywanie raka prostaty i agresywność guza. Int J Mol Sci 2014,
15: 13615 13623.
80. Allott EH, Howard LE, Cooperberg MR, Kane CJ, Aronson WJ, Terris MK,
Amling CL, Freedland SJ: Pooperacyjne stosowanie statyn i ryzyko biochemiczne
nawrót po radykalnej prostatektomii: wyniki z Shared
Baza danych Regionalnego Szpitala Onkologicznego Równego Dostępu (SEARCH). BJU Int 2014,
114: 661 666.
81. Jespersen CG, Norgaard M, Friis S, Skriver C, Borre M: Stosowanie statyn i ryzyko
rak prostaty: duńskie populacyjne badanie kliniczno-kontrolne,
1997-2010. Epidemiol raka 2014, 38:42.
82. Meyers CD, Kashyap ML: Farmakologiczne podwyższenie wysokiej gęstości
lipoproteiny: najnowsze informacje na temat mechanizmu działania i miażdżycy
ochrona. Curr Opin Cardiol 2004, 19:366.
83. Xia P, Vadas MA, Rye KA, Barter PJ, Gamble JR: lipoproteiny o wysokiej gęstości
(HDL) przerywa szlak sygnałowy kinazy sfingozynowej. Możliwe
mechanizm ochrony przed miażdżycą przez HDL. J Biol Chem
1999, 274:33143-33147.
84. Kotani K, Sekine Y, Ishikawa S, Ikpot IZ, Suzuki K, Remaley AT: Wysoka gęstość
lipoproteina i rak prostaty: przegląd. J Epidemiol 2013,
23: 313 319.
85. Soni MG, Thurmond TS, Miller ER 3., Spriggs T, Bendich A, Omaye ST:
Bezpieczeństwo witamin i minerałów: kontrowersje i perspektywy. Toksykolo
Sci 2010, 118:348.
86. Neuhouser ML, Barnett MJ, Kristal AR, Ambrosone CB, Król I, Thornquist M,
Goodman G: (n-6) wzrost liczby PUFA i nabiał zmniejsza prostatę
ryzyko raka u nałogowych palaczy. J Nutr 2007, 137: 1821-1827.
87. Karppi J, Kurl S, Laukkanen JA, Kauhanen J: Surowica beta-karoten w stosunku
na ryzyko raka prostaty: ryzyko choroby niedokrwiennej serca Kuopio
Badanie czynnikowe. Nutr Cancer 2012, 64:361.
88. Margalit DN, Kasperzyk JL, Martin NE, Sesso HD, Gaziano JM, Ma J, Stampfer
MJ, Mucci LA: Stosowanie antyoksydantów beta-karotenu podczas radioterapii
oraz wyniki badań nad rakiem prostaty w badaniu Physicians� Health Study. Int J Radiat
Oncol Biol Phys 2012, 83:28.
89. Roswall N, Larsen SB, Friis S, Outzen M, Olsen A, Christensen J, Dragsted LO,
Tj�nneland A: Spożycie mikroskładników odżywczych i ryzyko raka prostaty w a
kohorta duńskich mężczyzn w średnim wieku. Kontrola przyczyn raka 2013,
24: 1129 1135.
90. Gilbert R, Metcalfe C, Fraser WD, Donovan J, Hamdy F, Neal DE, Lane JA,
Martin RM: Związki krążącego retinolu, witaminy E i 1,25-
dihydroksywitamina D z rozpoznaniem, stadium i stopniem zaawansowania raka prostaty.
Kontrola przyczyn raka 2012, 23:1865-1873.
91. Bisulfi G, Foster BA, Karasik E, Gillard B, Miecznikowski J, Dhiman VK,
Smiraglia DJ: Niedobór kwasu foliowego w diecie blokuje progresję raka prostaty
w modelu TRAMP. Rak Poprzednia Res (Fila) 2011, 4:1825-1834.
92. Collin SM: Kwas foliowy i B12 w raku prostaty. Adv Clin Chem 2013,
60: 1 63.
93. Tio M, Andrici J, Cox MR, Eslick GD: Spożycie kwasu foliowego i ryzyko prostaty
rak: przegląd systematyczny i metaanaliza. Rak Prostaty Prostaty
Od 2014, 17:213.
94. Vollset SE, Clarke R, Lewington S, Ebbing M, Halsey J, Lonn E, Armitage J,
Manson JE, Hankey GJ, Spence JD, Galan P, B�naa KH, Jamison R, Gaziano
JM, Guarino P, Baron JA, Logan RF, Giovannucci EL, den Heijer M, Ueland
PM, Bennett D, Collins R, Peto R, B-Vitamin Treatment Trialists' Współpraca:
Wpływ suplementacji kwasem foliowym na raka ogólnego i miejscowo-specyficznego
częstość występowania w badaniach z randomizacją: metaanalizy danych na temat 50,000 XNUMX
osoby. Lancet 2013, 381:1029-1036.
95. Verhage BA, Cremers P, Schouten LJ, Goldbohm RA, van den Brandt PA:
Kwas foliowy i witamery kwasu foliowego w diecie a ryzyko raka prostaty
w holenderskim badaniu kohortowym. Kontrola przyczyn raka 2012,
23: 2003 2011.
96. Tavani A, Malerba S, Pelucchi C, Dal Maso L, Zucchetto A, Serraino D, Levi F,
Montella M, Franceschi S, Zambon A, La Vecchia C: foliany dietetyczne i
ryzyko zachorowania na raka w sieci badań kliniczno-kontrolnych. Annę Oncol 2012,
23: 2737 2742.
97. Moreira DM, Banez LL, Presti JC Jr, Aronson WJ, Terris MK, Kane CJ, Amling
CL, Freedland SJ: Wysoki poziom kwasu foliowego w surowicy wiąże się ze zmniejszeniem
nawrót biochemiczny po radykalnej prostatektomii: wyniki
SZUKAJ bazę danych. Int Braz J Urol 2013, 39:312. dyskusja 318.
98. Han YY, Song JY, Talbott EO: folian w surowicy i antygen specyficzny dla prostaty w
Stany Zjednoczone. Kontrola przyczyn raka 2013, 24:1595.
99. Rycyna KJ, Bacich DJ, O'Keefe DS: Przeciwstawne role kwasu foliowego w prostacie
nowotwór. Urologia 2013, 82:1197.
100. Gilbert R, Martin R, Beynon R, Harris R, Savovic J, Zuccolo L, Bekkering GE,
Fraser WD, Sterne JA, Metcalfe: Stowarzyszenia krążące i dietetyczne
witamina D z ryzykiem raka prostaty: przegląd systematyczny i dawka�
metaanaliza odpowiedzi. Kontrola przyczyn raka 2011, 22:319.
101. Schenk JM, Till CA, Tangen CM, Goodman PJ, Song X, Torkko KC, Kristal AR,
Peters U, Neuhouser ML: Stężenia 25-hydroksywitaminy d w surowicy i
ryzyko raka prostaty: wyniki badania profilaktyki raka prostaty.
Biomarkery epidemii raka Poprzednia 2014, 23:1484.
102. Schwartz GG: Witamina D we krwi a ryzyko raka prostaty: lekcje
z badania profilaktyki raka z selenem i witaminą E oraz
Próba zapobiegania rakowi prostaty. Biomarkery epidemii raka Poprzednia 2014,
23: 1447 1449.
103. Giangreco AA, Vaishnav A, Wagner D, Finelli A, Fleshner N, Van der Kwast T,
Vieth R, Nonn L: supresorowe mikroRNA guza, miR-100 i -125b, są
regulowany przez 1,25-dihydroksywitaminę D w pierwotnych komórkach prostaty i w
tkanka pacjenta. Rak Poprzednia Res (Fila) 2013, 6:483.
104. Hollis BW, Marshall DT, Savage SJ, Garrett-Mayer E, Kindy MS, Gattoni-Celli S:
Suplementacja witaminą D3, rak prostaty niskiego ryzyka i zdrowie
dysproporcje. J Steroid Biochem Mol Biol 2013, 136:233.
105. Sha J, Pan J, Ping P, Xuan H, Li D, Bo J, Liu D, Huang Y: efekt synergiczny
oraz mechanizm działania witaminy A i witaminy D na wywoływanie apoptozy
komórki raka prostaty. Mol Biol Rep 2013, 40:2763.
106. Chandler PD, Giovannucci EL, Scott JB, Bennett GG, Ng K, Chan AT, Hollis
BW, Emmons KM, Fuchs CS, Drake BF: zerowy związek między witaminą D
i poziom PSA wśród czarnych mężczyzn w próbie suplementacji witaminy D.
Biomarkery epidemii raka Poprzednia 2014, 23:1944.
107. Skaaby T, Husemoen LL, Thuesen BH, Pisinger C, Jorgensen T, Roswall N,
Larsen SC, Linneberg A: Prospektywne badanie populacyjne
związek między poziomami 25-hydroksywitaminy-D w surowicy a
częstość występowania określonych rodzajów raka. Biomarkery epidemii raka Poprzednia
2014, 23:1220-1229.
108. Holt SK, Kolb S, Fu R, Horst R, Feng Z, Stanford JL: Poziomy cyrkulacji
25-hydroksywitamina D i prognoza raka prostaty. Epidemiol raka
2013, 37:666-670.
109. Wong YY, Hyde Z, McCaul KA, Yeap BB, Golledge J, Hankey GJ, Flicker L:
U starszych mężczyzn niższe stężenie 25-hydroksywitaminy D w osoczu jest związane z
zmniejszona częstość występowania raka prostaty, ale nie raka jelita grubego lub płuc.
PLoS One 2014, 9:e99954.
110. Xu Y, Shao X, Yao Y, Xu L, Chang L, Jiang Z, Lin Z: Pozytywne skojarzenie
między poziomem krążącej 25-hydroksywitaminy D a ryzykiem raka prostaty:
nowe ustalenia ze zaktualizowanej metaanalizy. J Cancer Res Clin Oncol
2014, 140:1465-1477.
111. Meyer HE, Robsahm TE, Bjorge T, Brustad M, Blomhoff R: Witamina D, sezon,
i ryzyko raka prostaty: zagnieżdżone badanie przypadku�kontrolne w ramach
Norweskie badania zdrowotne. Am J Clin Nutr 2013, 97:147.
112. Kristal AR, Till C, Song X, Tangen CM, Goodman PJ, Neuhauser ML, Schenk
JM, Thompson IM, Meyskens FL Jr, Goodman GE, Minasian LM, Parnes HL,
Klein EA: Witamina D w osoczu i ryzyko raka prostaty: wyniki z
Próba zapobiegania rakowi z selenem i witaminą E. Epidemiol raka
Biomarkery Poprzednia 2014, 23:1494.
113. Weinstein SJ, Mondul AM, Kopp W, Rager H, Virtamo J, Albanes D:
Krążąca 25-hydroksywitamina D, białko wiążące witaminę D i ryzyko
rak prostaty. Int J Cancer 2013, 132:2940.
114. Guo Z, Wen J, Kan Q, Huang S, Liu X, Sun N, Li Z: Brak skojarzeń
między polimorfizmami genu receptora witaminy D FokI i BsmI a ryzykiem raka prostaty: zaktualizowana metaanaliza obejmująca 21,756 2013 osób. Guz Biol 34, 3189:3200115. Wang L, Sesso HD, Glynn RJ, Christen WG, Bubes V, Manson JE, Buring JE,
Gaziano JM: Suplementacja witaminą E i C a ryzyko raka u mężczyzn:
obserwacja po badaniu w randomizowanym badaniu Physicians� Health Study II.
Am J Clin Nutr 2014, 100:915.
116. Virtamo J, Taylor PR, Kontto J, Mannisto S, Utriainen M, Weinstein SJ,
Huttunen J, Albanes D: Wpływ alfa-tokoferolu i beta-karotenu
suplementacja zachorowalności i umieralności na nowotwory: 18 lat
obserwacja po interwencji alfa-tokoferolu, beta-karotenu
Badanie profilaktyki raka. Int J Cancer 2014, 135:178�185.
117. Basu A, Imrhan V: Witamina E i rak prostaty: czy bursztynian witaminy E a
lepszy środek chemoprewencyjny? Nutr Rev 2005, 63:247.
118. Lawson KA, Wright ME, Subar A, Mouw T, Hollenbeck A, Schatzkin A,
Leitzmann MF: Stosowanie multiwitaminy i ryzyko raka prostaty w
National Institutes of Health-AARP Diet and Health Study. J Natl Rak
W 2007 r., 99:754.
119. Calle EE, Rodriguez C, Jacobs EJ, Almon ML, Chao A, McCullough ML,
Feigelson HS, Thun MJ: Profilaktyka raka Amerykańskiego Towarzystwa Onkologicznego
Badanie II Odżywianie Kohorta: uzasadnienie, projekt badania i punkt odniesienia
cechy. Rak 2002, 94:2490.
120. Weinstein SJ, Peters U, Ahn J, Friesen MD, Riboli E, Hayes RB, Albanes D:
Stężenia alfa-tokoferolu i gamma-tokoferolu w surowicy oraz
Ryzyko raka prostaty w badaniu przesiewowym PLCO: przypadek zagnieżdżony�kontrola
badanie. PLoS One 2012, 7:e40204.
121. Cui R, Liu ZQ, Xu Q: Poziomy alfa-tokoferolu we krwi, gamma-tokoferolu
i ryzyko raka prostaty: metaanaliza badań prospektywnych.
PLoS One 2014, 9:e93044.
122. Major JM, Yu K, Weinstein SJ, Berndt SI, Hyland PL, Yeager M, Chanock S,
Albanes D: Warianty genetyczne odzwierciedlające wyższy poziom witaminy E u mężczyzn są
związane ze zmniejszonym ryzykiem raka prostaty. J Nutr maj 2014,
144: 729 733.
123. Klein EA, Thompson IM Jr, Tangen CM, Crowley JJ, Lucia MS, Goodman PJ,
Minasian LM, Ford LG, Parnes HL, Gaziano JM, Karp DD, Lieber MM, Walther
PJ, Klotz L, Parsons JK, Chin JL, Darke AK, Lippman SM, Goodman GE,
Meyskens FL Jr, Baker LH: Witamina E i ryzyko raka prostaty:
Badanie profilaktyki raka z selenem i witaminą E (SELECT). JAMA 2011,
306: 1549 1556.
124. Albanes D, Till C, Klein EA, Goodman PJ, Mondul AM, Weinstein SJ, aylor PR,
Parnes HL, Gaziano JM, Piosenka X, Fleshner NE, Brown PH, Meyskens FL Jr,
Thompson IM: Tokoferole w osoczu a ryzyko raka prostaty w
Badanie profilaktyki raka z selenem i witaminą E (SELECT). Rak Poprzednia Res
(Fila) 2014, 7:886.
125. Kristal AR, Darke AK, Morris JS, Tangen CM, Goodman PJ, Thompson IM,
Meyskens FL Jr, Goodman GE, Minasian LM, Parnes HL, Lippman SM,
Klein EA: podstawowy stan selenu i działanie selenu i witaminy e
suplementacja na ryzyko raka prostaty. J Natl Cancer Inst 2014,
106:djt456.
126. Jamison JM, Gilloteaux J, Taper HS, Summers JL: Ocena in vitro
oraz działanie przeciwnowotworowe in vivo kombinacji witaminy C i K-3
przeciwko ludzkiemu rakowi prostaty. J Nutr 2001, 131:158S.160S.
127. Nimptsch K, Rohrmann S, Kaaks R, Linseisen J: Spożycie witaminy K w diecie
w odniesieniu do zachorowalności i umieralności na raka: wyniki z
Heidelberg kohorta Europejskiego Dochodzenia Prospektywnego do
Rak i odżywianie (EPIC-Heidelberg). Jestem J Clin Nutr 2010,
91: 1348 1358.
128. Ma RW, Chapman K: Systematyczny przegląd wpływu diety na prostatę
profilaktyka i leczenie raka. J Hum Nutr Diet 2009, 22:187.
quiz 200–182.
129. Bristow SM, Bolland MJ, MacLennan GS, Avenell A, Gray A, Gamble GD, Reid
IR: Suplementy wapnia a ryzyko raka: metaanaliza randomizowanych
kontrolowane próby. Br J Nutr 2013, 110:1384.
130. Williams CD, Whitley BM, Hoyo C, Grant DJ, Schwartz GG, Presti JC Jr, Iraggi
JD, Newman KA, Gerber L, Taylor LA, McKeever MG, Freedland SJ: dietetyka
wapń i ryzyko raka prostaty: badanie kliniczno-kontrolne wśród USA
weterani. Poprzednia Chroniczna Dis 2012, 9:E39.
131. Hori S, Butler E, McLoughlin J: Rak prostaty i dieta: do myślenia?
BJU Int 2011, 107:1348.
132. Geybels MS, Verhage BA, van Schooten FJ, Goldbohm RA, van den Brandt
PA: Zaawansowane ryzyko raka prostaty w stosunku do poziomu selenu w paznokciach.
J Natl Cancer Inst 2013, 105: 1394.
133. Singh RP, Agarwal R: Chemoprewencja raka prostaty przez sylibininę: ławka
do łóżka. Mol Carcinog 2006, 45:436.
134. Ting H, Deep G, Agarwal R: Molekularne mechanizmy pośredniczone przez sylibininę
chemoprewencja raka ze szczególnym naciskiem na raka prostaty.
AAPS J 2013, 15:707.
135. Ting HJ, Deep G, Jain AK, Cimic A, Sirintrapun J, Romero LM, Cramer SD,
Agarwal C, Agarwal R: sylibinina zapobiega rakowi prostaty pośredniczonemu przez komórki
różnicowanie naiwnych fibroblastów w fibroblasty związane z rakiem
fenotyp poprzez celowanie w TGF beta2. Mol Carcinog 2014. doi:10.1002/
mc.22135. [Epub z wyprzedzeniem]
136. Goel A, Aggarwal BB: Kurkumina, złota przyprawa z indyjskiego szafranu, jest
chemosensybilizator i radiouczulacz na nowotwory i chemoprotektor oraz
radioprotektor dla normalnych narządów. Nutr Cancer 2010, 62:919.
137. Khan N, Adhami VM, Mukhtar H: Apoptoza przez środki dietetyczne dla
profilaktyka i leczenie raka prostaty. Endocr Relat Cancer 2010,
17:R39–R52.
138. Heber D: Elagitaniny z granatu. W ziołolecznictwie: biomolekularne i
Aspekty kliniczne. Wydanie II. Pod redakcją Benzie IF, Wachtel-Galor S. Boca
Raton, FL: Prasa CRC; 2011.
139. Pantuck AJ, Leppert JT, Zomorodian N, Aronson W, Hong J, Barnard RJ,
Seeram N, Liker H, Wang H, Elashoff R, Heber D, Aviram M, Ignarro L,
Belldegrun A: Faza II badania soku z granatów dla mężczyzn z wschodami
antygen specyficzny dla prostaty po zabiegu chirurgicznym lub radioterapii prostaty
nowotwór. Clin Cancer Res 2006, 12:4018-4026.
140. Paller CJ, Ye X, Woźniak PJ, Gillespie BK, Sieber PR, Greengold RH, Stockton
BR, Hertzman BL, Efros MD, Roper RP, Liker HR, Carducci MA: randomizowany
Faza II badania ekstraktu z granatu dla mężczyzn z następującym wzrostem PSA
terapia początkowa zlokalizowanego raka prostaty. Rak Prostaty Prostatic Dis
2013, 16:50-55.
141. Freedland SJ, Carducci M, Kroeger N, Partin A, Rao JY, Jin Y, Kerkoutian S,
Wu H, Li Y, Creel P, Mundy K, Gurganus R, Fedor H, King SA, Zhang Y,
Heber D, Pantuck AJ: randomizowane badanie neoadjuwantowe z podwójnie ślepą próbą
skutki tkankowe pigułek POMx u mężczyzn z rakiem prostaty przed
radykalna prostatektomia. Rak Poprzednia Res (Phila) 2013, 6:1120.
142. Wang P, Aronson WJ, Huang M, Zhang Y, Lee RP, Heber D, Henning SM:
Polifenole i metabolity zielonej herbaty w tkance prostatektomii:
implikacje dla profilaktyki raka. Rak Poprzednia Res (Fila) 2010,
3: 985 993.
143. Kurahashi N, Sasazuki S, Iwasaki M, Inoue M, Tsugane S: zielona herbata
konsumpcja i ryzyko raka prostaty u japońskich mężczyzn: perspektywa
badanie. Am J Epidemiol 2008, 167:71.
144. McLarty J, Bigelow RL, Smith M, Elmajian D, Ankem M, Cardelli JA: Herbata
polifenole obniżają poziom specyficznego antygenu prostaty w surowicy,
czynnik wzrostu hepatocytów i czynnik wzrostu śródbłonka naczyń w
pacjentów z rakiem prostaty i hamują produkcję hepatocytów
czynnika wzrostu śródbłonka naczyń in vitro. Rak Poprzednia Res
(Fila) 2009, 2:673.
145. Bettuzzi S, Brausi M, Rizzi F, Castagnetti G, Peracchia G, Corti A:
Chemoprewencja raka prostaty u ludzi poprzez doustne podawanie
katechiny z zielonej herbaty u ochotników z wysokim stopniem śródnabłonkowym gruczołu krokowego
neoplazja: wstępny raport z rocznego badania dowodowego.
Cancer Res 2006, 66:1234.
146. Fraser SP, Peters A, Fleming-Jones S, Mukhey D, Djamgoz MB: Resweratrol:
hamujący wpływ na zachowanie komórek przerzutowych i bramkowany napięciem Na(+)
aktywność kanału w raku prostaty szczura in vitro. Rak orzecha 2014,
66: 1047 1058.
147. Oskarsson A, Spatafora C, Tringali C, Andersson AO: Hamowanie CYP17A1
aktywność resweratrolu, piceatannolu i syntetycznych analogów resweratrolu.
Prostata 2014, 74:839.
148. Ferruelo A, Romero I, Cabrera PM, Arance I, Andres G, Angulo JC: Skutki
resweratrol i inne polifenole winne na proliferację, apoptozę
i ekspresję receptora androgenowego w komórkach LNCaP. Actas Urol Esp lip-sierpień
2014, 38:397-404.
149. Osmond GW, Masko EM, Tyler DS, Freedland SJ, Pizzo S: In vitro i in vivo
ocena resweratrolu i 3,5-dihydroksy-4'-acetoksy-trans-stilbenu w
leczenie ludzkiego raka prostaty i czerniaka. J Surg Res
2013, 179:e141.e148.
150. Baur JA, Sinclair DA: Potencjał terapeutyczny resweratrolu: in vivo
dowód. Nat Rev Drug Discov 2006, 5:493.
151. Klink JC, Tewari AK, Masko EM, Antonelli J, Febbo PG, Cohen P, Dewhirst
MW, Pizzo SV, Freedland SJ: Resweratrol pogarsza przeżywalność myszy SCID z heteroprzeszczepami raka prostaty w sposób specyficzny dla linii komórkowej, poprzez paradoksalny wpływ na szlaki onkogenne. Prostata 2013, 73:754.
152. Huang WE, Zhao Y, Chen G, Baek SJ, McEntee MF, Minkin S, Biggerstaff JP,
Whelan J: Zyflamend, mieszanka poliziołowa, puch reguluje klasę I i
deacetylazy histonów klasy II i zwiększają poziom p21 u opornych na kastrację
komórki raka prostaty. BMC Complement Altern Med 2014, 14:68.
153. Huang EC, McEntee MF, Whelan J: Zyflamend, połączenie ziół
ekstrakty, atenuuje wzrost guza w mysich modelach heteroprzeszczepów
rak prostaty. Nutr Cancer 2012, 64:749.
154. Yan J, Xie B, Capodice JL, Katz AE: Zyflamend hamuje ekspresję i
funkcja receptora androgenowego i działa synergistycznie z bikalutymidem
hamować wzrost komórek raka prostaty. Prostata 2012, 72:244.
155. Kunnumakkara AB, Sung B, Ravindran J, Diagaradjane P, Deorukhkar A, Dey
S, Koca C, Tong Z, Gelovani JG, Guha S, Krishnan S, Aggarwal BB: Zyflamend
hamuje wzrost i uwrażliwia ludzkie guzy trzustki na
gemcytabina w ortotopowym modelu myszy poprzez modulację
wiele celów. Int J Cancer 2012, 131:E292�E303.
156. Capodice JL, Gorroochurn P, Cammack AS, Eric G, McKiernan JM, Benson
MC, Stone BA, Katz AE: Zyflamend u mężczyzn z prostatą o wysokim stopniu złośliwości
neoplazja śródnabłonkowa: wyniki badania klinicznego I fazy. J Soc Integracja
Oncol 2009, 7:43.
157. Rafailov S, Cammack S, Stone BA, Katz AE: Rola Zyflamenda,
ziołowy środek przeciwzapalny, jako potencjalny środek chemoprewencyjny przeciwko
rak prostaty: opis przypadku. Integr Cancer Ther 2007, 6:74.
158. Askari F, Parizi MK, Jessri M, Rashidkhani B: Spożycie owoców i warzyw w
związek z rakiem prostaty u irańskich mężczyzn: badanie kliniczno-kontrolne.
Asian Pac J Cancer Poprzednia 2014, 15:5223.
159. Liu B, Mao Q, Cao M, Xie L: Spożycie warzyw krzyżowych i ryzyko
rak prostaty: metaanaliza. Int J Urol 2012, 19:134–141.
160. Richman EL, Carroll PR, Chan JM: Spożycie warzyw i owoców po
diagnoza i ryzyko progresji raka prostaty. Int J Cancer 2012,
131: 201 210.
161. Hsing AW, Chokkalingam AP, Gao YT, Madigan MP, Deng J., Gridley G,
Fraumeni JF Jr: Warzywa Allium a ryzyko raka prostaty: a
badanie populacyjne. J Natl Cancer Inst 2002, 94:1648-1651.
162. Chan R, Lok K, Woo J: Rak prostaty i spożycie warzyw.
Mol Nutr Food Res 2009, 53:201.
163. Thomas R, Williams M, Sharma H, Chaudry A, Bellamy P: podwójnie ślepy,
randomizowane badanie kontrolowane placebo oceniające wpływ
Bogaty w polifenole pełnowartościowy suplement diety dotyczący progresji PSA u mężczyzn
z rakiem prostaty – badanie UK NCRN Pomi-T. Rak prostaty prostaty
Od 2014, 17:180.
164. Yang CM, Lu IH, Chen HY, Hu ML: Likopen hamuje proliferację
zależne od androgenów komórki ludzkiego nowotworu prostaty poprzez aktywację
szlak PPARgamma-LXRalfa-ABCA1. J Nutr Biochem 2012, 23:8.
165. Qiu X, Yuan Y, Vaishnav A, Tessel MA, Nonn L, van Breemen RB: Skutki
likopen na ekspresję białka w pierwotnym nabłonku gruczołu krokowego człowieka
komórki. Rak Poprzednia Res (Fila) 2013, 6:419.
166. Boileau TW, Liao Z, Kim S, Lemeshow S, Erdman JW Jr, Clinton SK: Prostata
karcynogeneza w N-metylo-N-nitrozomoczniku (NMU)-traktowanym testosteronem
szczury karmione pomidorami w proszku, likopenem lub dietami o ograniczonej energii. J Natl
Cancer Inst 2003, 95:1578.
167. Konijeti R, Henning S, Moro A, Szejk A, Elashoff D, Shapiro A, Ku M,
Powiedział JW, Heber D, Cohen P, Aronson WJ: Chemoprewencja prostaty
raka z likopenem w modelu TRAMP. Prostata 2010, 70:1547.
168. Giovannucci E, Rimm EB, Liu Y, Stampfer MJ, Willett WC: perspektywa
badanie produktów pomidorowych, likopenu i ryzyka raka prostaty. J Natl
Cancer Inst 2002, 94:391.
169. Zu K, Mucci L, Rosner BA, Clinton SK, Loda M, Stampfer MJ, Giovannucci E:
Likopen dietetyczny, angiogeneza i rak prostaty: perspektywa
badania w erze antygenów specyficznych dla prostaty. J Natl Cancer Inst 2014,
106:djt430.
170. Gann PH, Ma J, Giovannucci E, Willett W, Sacks FM, Hennekens CH, Stampfer
MJ: Niższe ryzyko raka prostaty u mężczyzn z podwyższonym poziomem likopenu w osoczu
poziomy: wyniki analizy prospektywnej. Cancer Res 1999, 59:1225.
171. Kristal AR, Till C, Platz EA, Song X, King IB, Neuhouser ML, Ambrosone CB,
Thompson IM: Stężenie likopenu w surowicy i ryzyko raka prostaty:
wynika z badania profilaktyki raka prostaty. Epidemiol raka
Biomarkery Poprzednia 2011, 20:638.
172. Kirsh VA, Mayne ST, Peters U, Chatterjee N, Leitzmann MF, Dixon LB, Urban
DA, Crawford ED, Hayes RB: Prospektywne badanie likopenu i pomidora
spożycie produktu i ryzyko raka prostaty. Biomarkery epidemii raka
Poprzednia 2006, 15:92.
173. Mariani S, Lionetto L, Cavallari M, Tubaro A, Rasio D, De Nunzio C, Hong
GM, Borro M, Simmaco M: Niskie stężenie likopenu w prostacie jest
związane z rozwojem raka prostaty u pacjentów z wysokim stopniem złośliwości
śródnabłonkowa neoplazja prostaty. Int J Mol Sci 2014, 15:1433.
174. Kucuk O, Sarkar FH, Djuric Z, Sakr W, Pollak MN, Khachik F, Banerjee M,
Bertram JS, Wood DP Jr: Efekty suplementacji likopenu u pacjentów
ze zlokalizowanym rakiem prostaty. Exp Biol Med (Maywood) 2002, 227:881.
175. Chen L, Stacewicz-Sapuntzakis M, Duncan C, Sharifi R, Ghosh L, van
Breemen R, Ashton D, Bowen PE: oksydacyjne uszkodzenie DNA w prostacie
pacjenci z rakiem spożywający przystawki na bazie sosu pomidorowego jako pełnowartościowe jedzenie
interwencja. J Natl Cancer Inst 2001, 93: 1872-1879.
176. van Breemen RB, Sharifi R, Viana M, Pajkovic N, Zhu D, Yuan L, Yang Y,
Bowen PE, Stacewicz-Sapuntzakis M: Przeciwutleniające działanie likopenu w
Afroamerykanie z rakiem prostaty lub łagodnym przerostem prostaty:
randomizowane, kontrolowane badanie. Rak Poprzednia Res (Fila) 2011, 4:711.
177. Shafique K, McLoone P, Qureshi K, Leung H, Hart C, Morrison DS: Kawa
spożycie i ryzyko raka prostaty: dalsze dowody na odwrotność
relacja. Nutr J 2012, 11:42.
178. Wilson KM, Kasperzyk JL, Rider JR, Kenfield S, van Dam RM, Stampfer MJ,
Giovannucci E, Mucci LA: Spożycie kawy a ryzyko raka prostaty
i postęp w badaniu kontrolnym pracowników służby zdrowia. J Natl
Cancer Inst 2011, 103:876.
179. Bosire C, Stampfer MJ, Subar AF, Wilson KM, Park Y, Sinha R: Kawa
spożycie i ryzyko całkowitego i śmiertelnego raka prostaty w
Badanie diety i zdrowia NIH-AARP. Kontrola przyczyn raka 2013, 24:1527-1534.
180. Arab L, Su LJ, Steck SE, Ang A, Fontham ET, Bensen JT, Mohler JL: Kawa
konsumpcja i agresywność raka prostaty wśród Afrykanów i
Amerykanie rasy kaukaskiej w badaniu populacyjnym. Rak Nutr 2012,
64: 637 642.
181. Phillips RL, Snowdon DA: Związek spożywania mięsa i kawy z nowotworami
jelita grubego, piersi i prostaty wśród Adwentystów Dnia Siódmego:
wstępne rezultaty. Cancer Res 1983, 43:2403 s.2408s.
182. Hsing AW, McLaughlin JK, Schuman LM, Bjelke E, Gridley G, Wacholder S,
Chien HT, Blot WJ: Dieta, palenie tytoniu i śmiertelny rak prostaty: wyniki
z badania kohortowego Bractwa Luterańskiego. Cancer Res 1990,
50: 6836 6840.
183. Cao S, Liu L, Yin X, Wang Y, Liu J, Lu Z: Spożycie kawy i ryzyko
rak prostaty: metaanaliza prospektywnych badań kohortowych.
Karcynogeneza 2014, 35:256.
184. Nordmann AJ, Suter-Zimmermann K, Bucher HC, Shai I, Tuttle KR,
Estruch R, Briel M: Metaanaliza porównująca Morze Śródziemne z niskotłuszczowym
diety mające na celu modyfikację czynników ryzyka sercowo-naczyniowego. Jestem J Med 2011,
124:841. e851.
185. Kapiszewska M: Stosunek spożycia warzyw do mięsa jako istotny
czynnik determinujący dietę przeciwnowotworową. Morze Śródziemne kontra
inne kraje europejskie. Forum Nutr 2006, 59:130.
186. Kenfield SA, Dupre N, Richman EL, Stampfer MJ, Chan JM, Giovannucci EL:
Dieta śródziemnomorska a ryzyko i śmiertelność z powodu raka prostaty w zdrowiu
Profesjonalne badanie uzupełniające. Eur Urol 2014, 65:887.
187. Ambrosini GL, Fritschi L, de Klerk NH, Mackerras D, Leavy J: Wzorce żywieniowe
zidentyfikowane za pomocą analizy czynnikowej i ryzyka raka prostaty: kontrola przypadku
studiować w Australii Zachodniej. Ann Epidemiol 2008, 18:364.
188. Baade PD, Youlden DR, Krnjacki LJ: Międzynarodowa epidemiologia prostaty
rak: rozmieszczenie geograficzne i trendy sekularne. Mol Nutr Food Res
2009, 53:171-184.
189. Muller DC, Severi G, Baglietto L, Krishnan K, angielski DR, Hopper JL, Giles GG:
Wzorce żywieniowe a ryzyko raka prostaty. Biomarkery epidemii raka Poprzednia
2009, 18:3126-3129.
190. Tseng M, Breslow RA, DeVellis RF, Ziegler RG: Wzorce żywieniowe i prostata
ryzyko zachorowania na raka w National Health and Nutrition Examination Survey
Kohorta badania epidemiologicznego. Biomarkery epidemii raka Poprzednia
2004, 13:71-77.
191. Wu K, Hu FB, Willett WC, Giovannucci E: Wzorce żywieniowe i ryzyko
rak prostaty u mężczyzn w USA. Biomarkery epidemii raka Poprzednia 2006,
15: 167 171.
192. Daubenmier JJ, Weidner G, Marlin R, Crutchfield L, Dunn-Emke S, Chi C,
Gao B, Carroll P, Ornish D: Styl życia i jakość życia związana ze zdrowiem
mężczyźni z rakiem prostaty leczeni pod aktywnym nadzorem. Urologia
2006, 67:125-130.
193. Parsons JK, Newman VA, Mohler JL, Pierce JP, Flatt S, Marshall J: Dieta
modyfikacja u pacjentów z rakiem prostaty pod aktywnym nadzorem: a
randomizowane, wieloośrodkowe studium wykonalności. BJU Int 2008, 101:1227.
194. Mosher CE, Sloane R, Morey MC, Snyder DC, Cohen HJ, Miller PE,
Demark-Wahnefried W: Związki między czynnikami stylu życia a jakością
życia wśród starszych odległych raków piersi, prostaty i jelita grubego
ocalali. Rak 2009, 115:4001-4009.
195. Bhindi B, Locke J, Alibhai SM, Kulkarni GS, Margel DS, Hamilton RJ, Finelli A,
Trachtenberg J, Zlotta AR, Toi A, Hersey KM, Evans A, van der Kwast TH,
Fleshner NE: Analiza związku między zespołem metabolicznym
i ryzyko raka prostaty: analiza dużej kohorty klinicznej. Eur Urol 2014.
doi:10.1016/j.eururo.2014.01.040. [Epub z wyprzedzeniem]
196. Esposito K, Chiodini P, Capuano A, Bellastella G, Maiorino MI, Parretta E,
Lenzi A, Giugliano D: Wpływ zespołu metabolicznego i jego elementów
na temat ryzyka raka prostaty: metaanaliza. J Endocrinol Invest 2013,
36: 132 139.
197. Departament Rolnictwa Stanów Zjednoczonych i Departament Zdrowia Stanów Zjednoczonych oraz
Usługi człowieka. Wytyczne dietetyczne dla Amerykanów, 2010. Wydanie siódme.
Waszyngton, DC: US Government Printing Office, grudzień 2010 r.
Zamknij akordeon
Profesjonalny zakres praktyki *
Informacje zawarte w niniejszym dokumencie na temat „Rak prostaty, odżywianie i interwencje dietetyczne„ nie ma na celu zastąpienia relacji jeden na jeden z wykwalifikowanym pracownikiem służby zdrowia lub licencjonowanym lekarzem i nie jest poradą medyczną. Zachęcamy do podejmowania decyzji dotyczących opieki zdrowotnej na podstawie badań i współpracy z wykwalifikowanym pracownikiem służby zdrowia.
Informacje o blogu i zakres dyskusji
Nasz zakres informacji ogranicza się do leków chiropraktycznych, mięśniowo-szkieletowych, fizykalnych, odnowy biologicznej, przyczyni się do etiologii zaburzenia trzewno-somatyczne w prezentacjach klinicznych, powiązanej dynamice klinicznej odruchu somato-trzewnego, kompleksach podwichnięć, wrażliwych kwestiach zdrowotnych i/lub artykułach, tematach i dyskusjach z zakresu medycyny funkcjonalnej.
Zapewniamy i prezentujemy współpraca kliniczna ze specjalistami z różnych dziedzin. Każdy specjalista podlega zakresowi swojej praktyki zawodowej i jurysdykcji licencyjnej. Stosujemy protokoły funkcjonalnego zdrowia i dobrego samopoczucia, aby leczyć i wspierać opiekę nad urazami lub zaburzeniami układu mięśniowo-szkieletowego.
Nasze filmy, posty, tematy, tematy i spostrzeżenia obejmują kwestie kliniczne, problemy i tematy, które bezpośrednio lub pośrednio odnoszą się do naszego zakresu praktyki klinicznej i wspierają ją.*
Nasze biuro podjęło zasadne próby dostarczenia wspierających cytatów i zidentyfikowało odpowiednie badanie lub badania wspierające nasze posty. Na żądanie udostępniamy kopie badań wspierających, które są dostępne dla organów regulacyjnych i opinii publicznej.
Rozumiemy, że zajmujemy się sprawami, które wymagają dodatkowego wyjaśnienia, w jaki sposób może to pomóc w konkretnym planie opieki lub protokole leczenia; w związku z tym, aby dokładniej omówić powyższy temat, prosimy o kontakt Dr Alex Jimenez, DC, lub skontaktować się z nami pod adresem 915-850-0900.
Jesteśmy tutaj, aby pomóc Tobie i Twojej rodzinie.
Błogosławieństwa
Dr Alex Jimenez OGŁOSZENIE, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionmedicine.com
Licencjonowany jako lekarz chiropraktyki (DC) w Texas & Nowy Meksyk*
Licencja Texas DC nr TX5807, Licencja DC w Nowym Meksyku nr NM-DC2182
Licencjonowana pielęgniarka dyplomowana (RN*) in Floryda
Licencja Florydy Licencja RN # RN9617241 (nr kontrolny 3558029)
Stan kompaktowy: Licencja wielostanowa: Uprawniony do wykonywania zawodu Stany 40*
Dr Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja cyfrowa wizytówka






