Zapalenie neurogenne, lub NI, jest procesem fizjologicznym, w którym mediatory są uwalniane bezpośrednio z nerwów skórnych, aby rozpocząć odpowiedź zapalną. Powoduje to powstawanie miejscowych reakcji zapalnych, w tym rumienia, obrzęku, wzrostu temperatury, tkliwości i bólu. Drobne niezmielinizowane aferentne somatyczne włókna C, które reagują na stymulację mechaniczną i chemiczną o niskiej intensywności, są w dużej mierze odpowiedzialne za uwalnianie tych mediatorów zapalnych.
Po stymulacji te szlaki nerwowe w nerwach skórnych szybko uwalniają energetyczne neuropeptydy lub substancję P i peptyd związany z genem kalcytoniny (CGRP) do mikrośrodowiska, wywołując serię odpowiedzi zapalnych. Istnieje znacząca różnica w zapaleniu immunogennym, które jest pierwszą ochronną i naprawczą odpowiedzią układu odpornościowego, gdy patogen dostanie się do organizmu, podczas gdy zapalenie neurogenne obejmuje bezpośrednie połączenie między układem nerwowym a reakcjami zapalnymi. Chociaż zapalenie neurogenne i zapalenie immunologiczne mogą występować jednocześnie, nie są one klinicznie nie do odróżnienia. Celem poniższego artykułu jest omówienie mechanizmu zapalenia neurogennego oraz roli obwodowego układu nerwowego w obronie gospodarza i immunopatologii.
Spis treści
Zapalenie neurogenne – rola obwodowego układu nerwowego w obronie gospodarza i immunopatologii
Abstrakcyjny
Tradycyjnie uważa się, że obwodowy układ nerwowy i odpornościowy pełnią odrębne funkcje. Ta linia jest jednak coraz bardziej zacierana przez nowe wglądy w neurogenne zapalenie. Neurony nocyceptorowe posiadają wiele takich samych ścieżek molekularnego rozpoznawania niebezpieczeństw jak komórki odpornościowe, aw odpowiedzi na niebezpieczeństwo obwodowy układ nerwowy komunikuje się bezpośrednio z układem odpornościowym, tworząc zintegrowany mechanizm ochronny. Gęsta sieć unerwienia włókien czuciowych i autonomicznych w tkankach obwodowych oraz duża szybkość transdukcji neuronalnej pozwala na szybką lokalną i ogólnoustrojową neurogenną modulację odporności. Wydaje się, że neurony obwodowe również odgrywają istotną rolę w dysfunkcji układu odpornościowego w chorobach autoimmunologicznych i alergicznych. Dlatego zrozumienie skoordynowanej interakcji neuronów obwodowych z komórkami układu odpornościowego może przyczynić się do rozwoju metod terapeutycznych w celu zwiększenia obrony gospodarza i tłumienia immunopatologii.
Wprowadzenie
Dwa tysiące lat temu Celsus zdefiniował stan zapalny jako obejmujący cztery główne objawy: ból (ból), kalor (ciepło), rubor (zaczerwienienie) i guz (obrzęk). zapalenie. Jednak od tego czasu ból był uważany głównie za objaw, a nie jako uczestnik powstawania stanu zapalnego. Z tej perspektywy pokazujemy, że obwodowy układ nerwowy odgrywa bezpośrednią i aktywną rolę w modulowaniu odporności wrodzonej i nabytej, tak że układy odpornościowy i nerwowy mogą mieć wspólną zintegrowaną funkcję ochronną w obronie gospodarza i odpowiedzi na uszkodzenie tkanki, co jest skomplikowane. interakcje, które również mogą prowadzić do patologii w chorobach alergicznych i autoimmunologicznych.
Przeżycie organizmów jest krytycznie zależne od zdolności do obrony przed potencjalnymi szkodami spowodowanymi uszkodzeniem tkanki i infekcją. Obrona gospodarza obejmuje zarówno zachowanie unikające, aby usunąć kontakt z niebezpiecznym (szkodliwym) środowiskiem (funkcja nerwowa), jak i aktywną neutralizację patogenów (funkcja immunologiczna). Tradycyjnie uważa się, że rola układu odpornościowego w zwalczaniu czynników zakaźnych i naprawie uszkodzeń tkanek jest całkiem odmienna od roli układu nerwowego, który przetwarza szkodliwe sygnały środowiskowe i wewnętrzne na aktywność elektryczną, aby wywoływać odczucia i odruchy (ryc. 1). Proponujemy, aby te dwa systemy były w rzeczywistości składnikami zunifikowanego mechanizmu obronnego. Somatosensoryczny układ nerwowy jest idealnie przystosowany do wykrywania niebezpieczeństwa. Po pierwsze, wszystkie tkanki silnie narażone na działanie środowiska zewnętrznego, takie jak nabłonkowe powierzchnie skóry, płuca, układ moczowy i pokarmowy, są gęsto unerwione przez nocyceptory, czyli włókna czuciowe o wysokim progu bólowym. Po drugie, transdukcja szkodliwych bodźców zewnętrznych jest niemal natychmiastowa, o rząd wielkości szybsza niż mobilizacja wrodzonego układu odpornościowego, a zatem może być „pierwszą odpowiedzią” w obronie gospodarza.
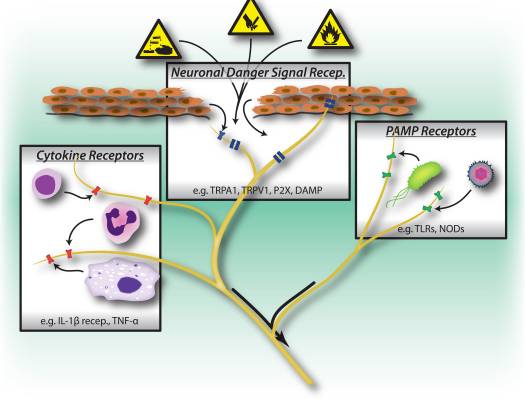
Rysunek 1: Szkodliwe bodźce, ścieżki rozpoznawania drobnoustrojów i stanów zapalnych wywołują aktywację obwodowego układu nerwowego. Neurony czuciowe posiadają kilka sposobów wykrywania obecności szkodliwych/szkodliwych bodźców. 1) Receptory sygnałów niebezpiecznych, w tym kanały TRP, kanały P2X i receptory związane z niebezpieczeństwem molekularnym (DAMP) rozpoznają egzogenne sygnały z otoczenia (np. ciepło, kwasowość, chemikalia) lub endogenne sygnały niebezpieczeństwa uwalniane podczas urazu/uszkodzenia tkanki (np. ATP, kwas moczowy, hydroksynonenale). 2) Receptory rozpoznawania wzorców (PRR), takie jak receptory Toll-podobne (TLR) i receptory typu Nod (NLR) rozpoznają wzorce molekularne związane z patogenem (PAMP) wydzielane przez atakujące bakterie lub wirusy podczas infekcji. 3) Receptory cytokinowe rozpoznają czynniki wydzielane przez komórki odpornościowe (np. IL-1beta, TNF-alfa, NGF), które aktywują kinazy mapowe i inne mechanizmy sygnalizacyjne w celu zwiększenia pobudliwości błony.
Oprócz ortodromicznych sygnałów wejściowych do rdzenia kręgowego i mózgu z obwodu, potencjały czynnościowe w neuronach nocyceptorowych mogą być również przekazywane antydromicznie w punktach rozgałęzień z powrotem do obwodu, czyli odruchu aksonu. Te, wraz z utrzymującymi się lokalnymi depolaryzacjami, prowadzą do szybkiego i lokalnego uwalniania mediatorów nerwowych zarówno z aksonów obwodowych, jak i końcówek (ryc. 2) 1. Klasyczne eksperymenty Goltza (w 1874) i Bayliss (w 1901) wykazały, że elektrycznie stymulujące korzenie grzbietowe indukuje rozszerzenie naczyń skóry, co doprowadziło do koncepcji „zapalenia neurogennego”, niezależnego od tego wytwarzanego przez układ odpornościowy (ryc. 3).
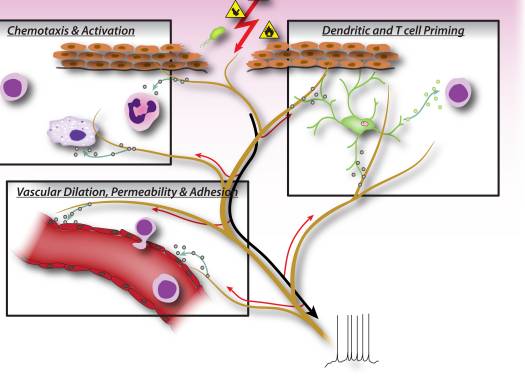
Rysunek 2: Czynniki neuronalne uwalniane z nocyceptorowych neuronów czuciowych bezpośrednio kierują chemotaksją leukocytów, hemodynamiką naczyń i odpowiedzią immunologiczną. Gdy szkodliwe bodźce aktywują sygnały aferentne w nerwach czuciowych, generowane są antydromowe odruchy aksonów, które indukują uwalnianie neuropeptydów na obwodowych zakończeniach neuronów. Te mediatory molekularne mają kilka działań zapalnych: 1) Chemotaksja i aktywacja neutrofili, makrofagów i limfocytów w miejscu uszkodzenia oraz degranulacja komórek tucznych. 2) Sygnalizacja do komórek śródbłonka naczyniowego w celu zwiększenia przepływu krwi, przecieku naczyniowego i obrzęku. Pozwala to również na łatwiejszą rekrutację leukocytów zapalnych. 3) Przygotowywanie komórek dendrytycznych w celu napędzania dalszego różnicowania limfocytów T pomocniczych do podtypów Th2 lub Th17.

Rysunek 3: Kalendarium postępów w zrozumieniu neurogennych aspektów zapalenia od Celsusa do dnia dzisiejszego.
W zapaleniu neurogennym pośredniczy uwalnianie neuropeptydów peptydu związanego z genem kalcytoniny (CGRP) i substancji P (SP) z nocyceptorów, które działają bezpośrednio na komórki śródbłonka naczyń i mięśni gładkich 2. CGRP wywołuje efekt rozszerzenia naczyń 5, 2, podczas gdy SP zwiększa przepuszczalność naczyń włosowatych, prowadząc do wynaczynienia osocza i obrzęku 3, 4, przyczyniając się do powstawania szorstkości, kaloryczności i guza Celsusa. Jednak nocyceptory uwalniają wiele dodatkowych neuropeptydów (baza danych online: www.neuropeptydy.nl/), w tym adrenomedulina, neurokininy A i B, wazoaktywny peptyd jelitowy (VIP), neuropeptyd (NPY) i peptyd uwalniający gastrynę (GRP), a także inne mediatory molekularne, takie jak glutaminian, tlenek azotu (NO) i cytokiny, takie jak eotaksyna 6.
Teraz doceniamy, że mediatory uwalniane z neuronów czuciowych na obwodzie nie tylko działają na układ naczyniowy, ale także bezpośrednio przyciągają i aktywują komórki odporności wrodzonej (komórki tuczne, komórki dendrytyczne) i komórki odporności nabytej (limfocyty T) 7�12. Przypuszczamy, że w ostrym stanie uszkodzenia tkanki neurogenne zapalenie ma działanie ochronne, ułatwiając fizjologiczne gojenie ran i obronę immunologiczną przeciwko patogenom poprzez aktywację i rekrutację komórek odpornościowych. Jednak taka komunikacja neuroimmunologiczna prawdopodobnie odgrywa również główną rolę w patofizjologii chorób alergicznych i autoimmunologicznych poprzez wzmacnianie patologicznych lub nieprzystosowawczych odpowiedzi immunologicznych. Na przykład na modelach zwierzęcych reumatoidalnego zapalenia stawów Levine i współpracownicy wykazali, że odnerwienie stawu prowadzi do uderzającego osłabienia zapalenia, które jest zależne od ekspresji neuronalnej substancji P 13, 14. W ostatnich badaniach nad alergicznym zapaleniem dróg oddechowych, zapaleniem okrężnicy i łuszczyca, pierwotne neurony czuciowe odgrywają kluczową rolę w inicjowaniu i zwiększaniu aktywacji odporności wrodzonej i nabytej 15.
Proponujemy zatem, aby obwodowy układ nerwowy odgrywał nie tylko bierną rolę w obronie gospodarza (wykrywanie szkodliwych bodźców i inicjowanie zachowań unikających), ale także aktywną rolę we współpracy z układem odpornościowym w modulowaniu odpowiedzi i zwalczaniu szkodliwych bodźce, rolę, którą można odwrócić, aby przyczynić się do choroby.
Wspólne ścieżki rozpoznawania zagrożeń w obwodowych układach nerwowych i wrodzonej odporności
Obwodowe neurony czuciowe są przystosowane do rozpoznawania zagrożeń dla organizmu dzięki wrażliwości na intensywne bodźce mechaniczne, termiczne i drażniące chemiczne (ryc. 1). Kanały jonowe przejściowego potencjału receptora (TRP) są najszerzej zbadanymi molekularnymi mediatorami nocycepcji, prowadzącymi nieselektywne wnikanie kationów po aktywacji przez różne szkodliwe bodźce. TRPV1 jest aktywowany przez wysokie temperatury, niskie pH i kapsaicynę, walinoidowy drażniący składnik papryczek chili 18. TRPA1 pośredniczy w wykrywaniu reaktywnych substancji chemicznych, w tym drażniących środowiskowych, takich jak gaz łzawiący i izotiocyjaniany przemysłowe 19, ale co ważniejsze, jest również aktywowany w tkance uszkodzenie przez endogenne sygnały molekularne, w tym 4-hydroksynonenal i prostaglandyny 20, 21.
Co ciekawe, neurony czuciowe mają wiele tych samych patogennych i niebezpiecznych szlaków receptorowych rozpoznawania molekularnego, co komórki wrodzonej odporności, co umożliwia im również wykrywanie patogenów (ryc. 1). W układzie odpornościowym patogeny drobnoustrojowe są wykrywane przez receptory rozpoznawania wzorców kodowanych w linii zarodkowej (PRR), które rozpoznają szeroko konserwatywne wzorce molekularne związane z patogenami egzogennymi (PAMP). Pierwszymi zidentyfikowanymi PRR byli członkowie rodziny receptorów Toll-podobnych (TLR), które wiążą się z drożdżami, składnikami ściany komórkowej pochodzenia bakteryjnego i wirusowym RNA 22. Po aktywacji PRR włączane są dalsze szlaki sygnałowe, które indukują wytwarzanie i aktywację cytokin odporności adaptacyjnej. Oprócz TLR, wrodzone komórki odpornościowe są aktywowane podczas uszkodzenia tkanki przez endogenne sygnały zagrożenia, znane również jako wzorce molekularne związane z uszkodzeniem (DAMP) lub alarminy 23, 24. Te sygnały zagrożenia obejmują uwalniane HMGB1, kwas moczowy i białka szoku cieplnego przez umierające komórki podczas martwicy, aktywację komórek odpornościowych podczas niezakaźnych odpowiedzi zapalnych.
PRR, w tym TLR 3, 4, 7 i 9, są wyrażane przez neurony nocyceptorowe, a stymulacja przez ligandy TLR prowadzi do indukcji prądów wewnętrznych i uwrażliwienia nocyceptorów na inne bodźce bólowe 25. Ponadto aktywacja neuronów czuciowych przez ligand TLR27 imikwimod prowadzi do aktywacji szlaku czuciowego specyficznego dla świądu7. Wyniki te wskazują, że ból i swędzenie związane z infekcją mogą być częściowo spowodowane bezpośrednią aktywacją neuronów przez czynniki pochodzące od patogenów, co z kolei aktywować komórki odpornościowe poprzez obwodowe uwalnianie neuronalnych cząsteczek sygnalizacyjnych.
Głównym DAMP/alarminem uwalnianym podczas uszkodzenia komórki jest ATP, który jest rozpoznawany przez receptory purynergiczne zarówno w neuronach nocyceptorowych, jak i komórkach odpornościowych28. Receptory purynergiczne składają się z dwóch rodzin: receptorów P30X, kanałów kationowych bramkowanych ligandami i receptorów P2Y, receptorów sprzężonych z białkiem G. W neuronach nocyceptorowych rozpoznawanie ATP następuje przez P2X2, co prowadzi do szybkiego zagęszczania prądów kationowych i bólu 3, 28 (ryc. 30), podczas gdy receptory P1Y przyczyniają się do aktywacji nocyceptorów poprzez uwrażliwienie TRP i kanałów sodowych bramkowanych napięciem. W makrofagach wiązanie ATP z receptorami P2X2 prowadzi do hiperpolaryzacji i dalszej aktywacji inflamasomu, kompleksu molekularnego ważnego w wytwarzaniu IL-7beta i IL-1. Dlatego ATP jest silnym sygnałem niebezpieczeństwa, który aktywuje zarówno neurony obwodowe, jak i wrodzone. odporność podczas urazu, a niektóre dowody sugerują nawet, że neurony eksprymują części maszynerii molekularnej inflamasomu 18.
Drugą stroną sygnałów zagrożenia w nocyceptorach jest rola kanałów TRP w aktywacji komórek odpornościowych. TRPV2, homolog TRPV1 aktywowany szkodliwym ciepłem, jest eksprymowany na wysokim poziomie we wrodzonych komórkach odpornościowych 32. Genetyczna ablacja TRPV2 prowadziła do defektów fagocytozy makrofagów i usuwania infekcji bakteryjnych 32. Komórki tuczne również wyrażają kanały TRPV, które mogą bezpośrednio pośredniczyć ich degranulacja 33. Pozostaje do ustalenia, czy endogenne sygnały niebezpieczeństwa aktywują komórki odpornościowe w podobny sposób jak nocyceptory.
Kluczowym środkiem komunikacji między komórkami odpornościowymi a neuronami nocyceptorowymi są cytokiny. Po aktywacji receptorów cytokin, szlaki transdukcji sygnału są aktywowane w neuronach czuciowych, prowadząc do dalszej fosforylacji białek błonowych, w tym TRP i kanałów bramkowanych napięciem (ryc. 1). Wynikające z tego uczulenie nocyceptorów oznacza, że normalnie nieszkodliwe bodźce mechaniczne i cieplne mogą teraz aktywować nocyceptory. Interleukina 1 beta i TNF-alfa to dwie ważne cytokiny uwalniane przez wrodzone komórki odpornościowe podczas zapalenia. IL-1beta i TNF-alfa są bezpośrednio wyczuwane przez nocyceptory, które wyrażają pokrewne receptory, indukują aktywację kinaz mapy p38, prowadząc do zwiększonej pobudliwości błony 34. Czynnik wzrostu nerwów (NGF) i prostaglandyna E(36) są również głównymi mediatorami stanu zapalnego uwalnianymi z komórek odpornościowych, które działają bezpośrednio na obwodowe neurony czuciowe, powodując uczulenie. Ważnym efektem uczulenia nocyceptorów przez czynniki immunologiczne jest zwiększone uwalnianie neuropeptydów na zakończeniach obwodowych, które dodatkowo aktywują komórki odpornościowe, indukując w ten sposób pętlę dodatniego sprzężenia zwrotnego, która napędza i ułatwia stan zapalny.
Sensoryczna kontrola układu nerwowego odporności wrodzonej i adaptacyjnej
We wczesnych fazach zapalenia neurony czuciowe wysyłają sygnały do komórek tucznych rezydujących w tkankach i komórek dendrytycznych, które są wrodzonymi komórkami odpornościowymi ważnymi w inicjowaniu odpowiedzi immunologicznej (ryc. 2). Badania anatomiczne wykazały bezpośrednie przyłożenie końcówek do komórek tucznych, jak również do komórek dendrytycznych, a neuropeptydy uwalniane z nocyceptorów mogą indukować degranulację lub produkcję cytokin w tych komórkach 7, 9, 37. Ta interakcja odgrywa ważną rolę w alergicznych drogach oddechowych zapalenie i zapalenie skóry 10.
Podczas efektorowej fazy zapalenia komórki odpornościowe muszą znaleźć drogę do konkretnego miejsca uszkodzenia. Wiele mediatorów uwalnianych z neuronów czuciowych, neuropeptydów, chemokin i glutaminianu działa chemotaktycznie na neutrofile, eozynofile, makrofagi i limfocyty T oraz zwiększa adhezję śródbłonka, co ułatwia zasiedlanie komórek układu odpornościowego 6, 38 (ryc. 41). Ponadto niektóre dowody sugerują, że neurony mogą bezpośrednio uczestniczyć w fazie efektorowej, ponieważ same neuropeptydy mogą mieć bezpośrednie funkcje przeciwdrobnoustrojowe 2.
Cząsteczki sygnałowe pochodzenia neuronowego mogą również kierować rodzajem zapalenia, przyczyniając się do różnicowania lub specyfikacji różnych typów adaptacyjnych limfocytów T układu odpornościowego. Antygen jest fagocytowany i przetwarzany przez wrodzone komórki odpornościowe, które następnie migrują do najbliższego węzła chłonnego i prezentują peptyd antygenowy natywnym limfocytom T. W zależności od typu antygenu, cząsteczek kostymulujących na wrodzonej komórce odpornościowej i kombinacji określonych cytokin, natywne limfocyty T dojrzewają do określonych podtypów, które najlepiej służą wysiłkowi zapalnemu w celu usunięcia patogennego bodźca. Limfocyty T CD4 lub limfocyty T pomocnicze (Th) można podzielić na cztery główne grupy: Th1, Th2, Th17 i limfocyty T regulatorowe (Treg). Komórki Th1 biorą udział głównie w regulacji odpowiedzi immunologicznych na wewnątrzkomórkowe mikroorganizmy i narządowe choroby autoimmunologiczne; Th2 mają kluczowe znaczenie dla odporności przeciwko patogenom zewnątrzkomórkowym, takim jak robaki pasożytnicze, i są odpowiedzialne za alergiczne choroby zapalne; Komórki Th17 odgrywają kluczową rolę w ochronie przed wyzwaniami drobnoustrojów, takimi jak bakterie i grzyby pozakomórkowe; Komórki Treg biorą udział w utrzymywaniu samotolerancji i regulowaniu odpowiedzi immunologicznych. Wydaje się, że na ten proces dojrzewania komórek T duży wpływ mają mediatory neuronów czuciowych. Neuropeptydy, takie jak CGRP i VIP, mogą skłaniać komórki dendrytyczne do odporności typu Th2 i zmniejszać odporność typu Th1 poprzez promowanie wytwarzania niektórych cytokin i hamowanie innych, a także poprzez zmniejszanie lub zwiększanie migracji komórek dendrytycznych do lokalnych węzłów chłonnych8 , 10, 43. Neurony czuciowe również znacząco przyczyniają się do alergicznego (głównie napędzanego przez Th2) zapalenia 17. Oprócz regulacji komórek Th1 i Th2, inne neuropeptydy, takie jak SP i Hemokinina-1, mogą bardziej kierować odpowiedź zapalną w kierunku Th17 lub Treg 44, 45, co oznacza, że neurony mogą również brać udział w regulowaniu procesu zapalnego. W immunopatologiach, takich jak zapalenie okrężnicy i łuszczyca, blokada mediatorów neuronalnych, takich jak substancja P, może znacząco tłumić uszkodzenia limfocytów T i immunologiczne 15, chociaż antagonizowanie jednego mediatora może samo w sobie mieć jedynie ograniczony wpływ na zapalenie neurogenne.
Biorąc pod uwagę, że cząsteczki sygnałowe uwalniane z obwodowych włókien nerwów czuciowych regulują nie tylko małe naczynia krwionośne, ale także chemotaksję, naprowadzanie, dojrzewanie i aktywację komórek odpornościowych, staje się jasne, że interakcje neuroimmunologiczne są znacznie bardziej skomplikowane niż wcześniej sądzono (ryc. 2). Co więcej, można sobie wyobrazić, że to nie pojedyncze mediatory nerwowe, ale raczej specyficzne kombinacje cząsteczek sygnałowych uwalnianych z nocyceptorów wpływają na różne etapy i typy odpowiedzi immunologicznych.
Autonomiczna kontrola odruchów odporności
Ważną rolę odgrywa również „obwód odruchowy” cholinergicznego autonomicznego układu nerwowego w regulacji obwodowych odpowiedzi immunologicznych 46. Nerw błędny jest głównym nerwem przywspółczulnym łączącym pień mózgu z narządami trzewnymi. Praca Kevina Tracey i innych wskazuje na silne uogólnione reakcje przeciwzapalne we wstrząsie septycznym i endotoksemii, wywołane przez eferentną aktywność nerwu błędnego, prowadzącą do supresji makrofagów obwodowych47. Błąd błędny aktywuje neurony obwodowego adrenergicznego zwoju trzewnego unerwiające śledzionę, co prowadzi do dalszego uwalniania acetylocholiny, która wiąże się z receptorami nikotynowymi alfa-49 na makrofagach w śledzionie i przewodzie pokarmowym. Indukuje to aktywację szlaku sygnałowego JAK7/STAT2 SOCS3, który silnie hamuje transkrypcję TNF-alfa 3. Adrenergiczny zwój trzewny komunikuje się również bezpośrednio z podzbiorem limfocytów T pamięci wytwarzających acetylocholinę, które hamują zapalne makrofagi 47.
Niezmienne limfocyty T naturalnego zabójcy (iNKT) to wyspecjalizowany podzbiór limfocytów T, który rozpoznaje lipidy drobnoustrojów w kontekście CD1d zamiast antygenów peptydowych. Komórki NKT stanowią kluczową populację limfocytów zaangażowaną w zwalczanie patogenów zakaźnych i regulację odporności ogólnoustrojowej. Komórki NKT przebywają i przemieszczają się głównie przez układ naczyniowy i zatoki śledziony i wątroby. Współczulne nerwy beta-adrenergiczne w wątrobie bezpośrednio sygnalizują modulację aktywności komórek NKT 50. Na przykład podczas mysiego modelu udaru (MCAO), mobilność komórek NKT wątroby była wyraźnie stłumiona, co zostało odwrócone przez odnerwienie współczulne lub antagonistów beta-adrenergicznych. Co więcej, ta immunosupresyjna aktywność neuronów noradrenergicznych na komórkach NKT doprowadziła do wzrostu infekcji ogólnoustrojowej i uszkodzenia płuc. Dlatego sygnały odprowadzające z neuronów autonomicznych mogą pośredniczyć w silnej immunosupresji.

Wgląd doktora Alexa Jimeneza
Zapalenie neurogenne to lokalna reakcja zapalna generowana przez układ nerwowy. Uważa się, że odgrywa fundamentalną rolę w patogenezie różnych problemów zdrowotnych, w tym migreny, łuszczycy, astmy, fibromialgii, egzemy, trądziku różowatego, dystonii i nadwrażliwości chemicznej. Chociaż zapalenie neurogenne związane z obwodowym układem nerwowym zostało szeroko zbadane, koncepcja zapalenia neurogennego w obrębie ośrodkowego układu nerwowego nadal wymaga dalszych badań. Jednak według kilku badań naukowych uważa się, że niedobór magnezu jest główną przyczyną zapalenia neurogennego. Poniższy artykuł przedstawia przegląd mechanizmów neurogennego zapalenia w układzie nerwowym, który może pomóc pracownikom służby zdrowia określić najlepsze podejście do leczenia różnych problemów zdrowotnych związanych z układem nerwowym.
wnioski
Jaka jest odpowiednia rola somatosensorycznego i autonomicznego układu nerwowego w regulacji stanu zapalnego i układu odpornościowego (ryc. 4)? Aktywacja nocyceptorów prowadzi do lokalnych odruchów aksonowych, które lokalnie rekrutują i aktywują komórki odpornościowe, a zatem są głównie prozapalne i ograniczone przestrzennie. W przeciwieństwie do tego, stymulacja autonomiczna prowadzi do ogólnoustrojowej immunosupresji poprzez wpływ na pule komórek odpornościowych w wątrobie i śledzionie. Słabo poznane są aferentne mechanizmy sygnalizacji obwodowej prowadzące do wyzwolenia immunosupresyjnego układu odruchu cholinergicznego układu nerwowego błędnego. Jednak 80% włókien nerwu błędnego to pierwotne aferentne włókna czuciowe, a zatem sygnały z wnętrzności, z których wiele potencjalnie jest napędzanych przez komórki układu odpornościowego, może prowadzić do aktywacji interneuronów w pniu mózgu, a przez nie do wyjścia we włóknach eferentnych nerwu błędnego 90.
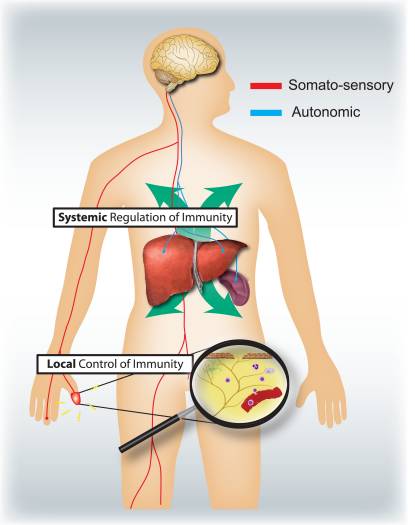
Rysunek 4: Sensoryczny i autonomiczny układ nerwowy modulują odpowiednio lokalną i ogólnoustrojową odpowiedź immunologiczną. Nocyceptory unerwiające powierzchnie nabłonka (np. skórę i płuca) wywołują zlokalizowane odpowiedzi zapalne, aktywując komórki tuczne i komórki dendrytyczne. W alergicznym zapaleniu dróg oddechowych, zapaleniu skóry i reumatoidalnym zapaleniu stawów neurony nocyceptorowe odgrywają rolę w wywoływaniu stanu zapalnego. Natomiast obwody autonomiczne unerwiające narządy trzewne (np. śledzionę i wątrobę) regulują ogólnoustrojową odpowiedź immunologiczną poprzez blokowanie aktywacji makrofagów i komórek NKT. W przypadku udaru i endotoksemii septycznej neurony te odgrywają rolę immunosupresyjną.
Zazwyczaj przebieg czasowy i charakter zapalenia, czy to podczas infekcji, reakcji alergicznych czy patologii autoimmunologicznych, jest definiowany przez kategorie zaangażowanych komórek odpornościowych. Ważne będzie, aby wiedzieć, jakie rodzaje komórek odpornościowych są regulowane przez sygnały czuciowe i autonomiczne. W odpowiedzi na to pytanie może pomóc systematyczna ocena tego, jakie mediatory mogą być uwalniane z nocyceptorów i neuronów autonomicznych oraz ekspresja receptorów dla nich przez różne wrodzone i nabyte komórki odpornościowe.
Podczas ewolucji podobne szlaki molekularne wykrywania zagrożeń rozwinęły się zarówno dla odporności wrodzonej, jak i nocycepcji, mimo że komórki mają zupełnie inne linie rozwojowe. Podczas gdy PRR i szkodliwe kanały jonowe bramkowane ligandami są badane oddzielnie przez immunologów i neurobiologów, granica między tymi dwoma obszarami jest coraz bardziej zacierana. Podczas uszkodzenia tkanek i infekcji patogennej, uwolnienie sygnałów zagrożenia prawdopodobnie doprowadzi do skoordynowanej aktywacji zarówno neuronów obwodowych, jak i komórek odpornościowych, ze złożoną komunikacją dwukierunkową i zintegrowaną obroną gospodarza. Anatomiczne umiejscowienie nocyceptorów na styku z otoczeniem, szybkość transdukcji neuronalnej i ich zdolność do uwalniania silnych koktajli mediatorów działających na układ odpornościowy pozwala obwodowemu układowi nerwowemu na aktywne modulowanie wrodzonej odpowiedzi immunologicznej i koordynację dalszej odporności nabytej. I odwrotnie, nocyceptory są bardzo wrażliwe na mediatory immunologiczne, które aktywują i uwrażliwiają neurony. Zapalenie neurogenne i immunologiczne nie są zatem niezależnymi jednostkami, ale działają razem jako urządzenia wczesnego ostrzegania. Jednak obwodowy układ nerwowy odgrywa również ważną rolę w patofizjologii i być może etiologii wielu chorób immunologicznych, takich jak astma, łuszczyca lub zapalenie jelita grubego, ponieważ jego zdolność do aktywacji układu odpornościowego może nasilać patologiczny stan zapalny 15�17. Leczenie zaburzeń immunologicznych może zatem wymagać ukierunkowania na nocyceptory, jak również na komórki odpornościowe.
Podziękowania
Dziękujemy NIH za wsparcie (2R37NS039518).
Podsumowując„Zrozumienie roli zapalenia neurogennego w obronie gospodarza i immunopatologii jest niezbędne do określenia właściwego podejścia do leczenia różnych problemów zdrowotnych układu nerwowego. Przyglądając się interakcjom neuronów obwodowych z komórkami odpornościowymi, pracownicy służby zdrowia mogą rozwijać podejścia terapeutyczne, aby jeszcze bardziej wzmocnić obronę gospodarza, a także zahamować immunopatologię. Celem powyższego artykułu jest pomoc pacjentom w zrozumieniu neurofizjologii klinicznej neuropatii, wśród innych problemów zdrowotnych związanych z uszkodzeniem nerwów. Informacje podane w National Center for Biotechnology Information (NCBI). Zakres naszych informacji ogranicza się do chiropraktyki oraz urazów i stanów kręgosłupa. Aby omówić ten temat, prosimy zapytać dr Jimeneza lub skontaktować się z nami pod adresem�915-850-0900 .
Kurator: dr Alex Jimenez
Dodatkowe tematy: Back Pain
Na ból pleców jest jedną z najczęstszych przyczyn niepełnosprawności i nieobecności w pracy na całym świecie. W rzeczywistości, ból pleców został przypisany jako drugi najczęstszy powód wizyt u lekarza, przewyższający jedynie infekcje górnych dróg oddechowych. Około 80 procent populacji doświadczy pewnego rodzaju bólu pleców przynajmniej raz w ciągu całego życia. Kręgosłup jest złożoną strukturą zbudowaną z kości, stawów, więzadeł i mięśni oraz innych miękkich tkanek. Z tego powodu urazy i / lub pogorszenie warunków, takich jak przepukliny, może ostatecznie prowadzić do objawów bólu pleców. Urazy sportowe lub wypadki samochodowe są często najczęstszą przyczyną bólu pleców, jednak czasami najprostsze ruchy mogą mieć bolesne skutki. Na szczęście alternatywne opcje leczenia, takie jak opieka chiropraktyczna, mogą pomóc złagodzić ból pleców poprzez zastosowanie korekcji kręgosłupa i manualnych manipulacji, ostatecznie poprawiając ulgę w bólu.

DODATKOWA WAŻNA TEMAT: Leczenie bólu pleców
WIĘCEJ TEMATY: EXTRA EXTRA:�Przewlekły ból i zabiegi
pusty
Referencje
Zamknij akordeon
Profesjonalny zakres praktyki *
Informacje zawarte w niniejszym dokumencie na temat „Rola zapalenia neurogennego„ nie ma na celu zastąpienia relacji jeden na jeden z wykwalifikowanym pracownikiem służby zdrowia lub licencjonowanym lekarzem i nie jest poradą medyczną. Zachęcamy do podejmowania decyzji dotyczących opieki zdrowotnej na podstawie badań i współpracy z wykwalifikowanym pracownikiem służby zdrowia.
Informacje o blogu i zakres dyskusji
Nasz zakres informacji ogranicza się do leków chiropraktycznych, mięśniowo-szkieletowych, fizykalnych, odnowy biologicznej, przyczyni się do etiologii zaburzenia trzewno-somatyczne w prezentacjach klinicznych, powiązanej dynamice klinicznej odruchu somato-trzewnego, kompleksach podwichnięć, wrażliwych kwestiach zdrowotnych i/lub artykułach, tematach i dyskusjach z zakresu medycyny funkcjonalnej.
Zapewniamy i prezentujemy współpraca kliniczna ze specjalistami z różnych dziedzin. Każdy specjalista podlega zakresowi swojej praktyki zawodowej i jurysdykcji licencyjnej. Stosujemy protokoły funkcjonalnego zdrowia i dobrego samopoczucia, aby leczyć i wspierać opiekę nad urazami lub zaburzeniami układu mięśniowo-szkieletowego.
Nasze filmy, posty, tematy, tematy i spostrzeżenia obejmują kwestie kliniczne, problemy i tematy, które bezpośrednio lub pośrednio odnoszą się do naszego zakresu praktyki klinicznej i wspierają ją.*
Nasze biuro podjęło zasadne próby dostarczenia wspierających cytatów i zidentyfikowało odpowiednie badanie lub badania wspierające nasze posty. Na żądanie udostępniamy kopie badań wspierających, które są dostępne dla organów regulacyjnych i opinii publicznej.
Rozumiemy, że zajmujemy się sprawami, które wymagają dodatkowego wyjaśnienia, w jaki sposób może to pomóc w konkretnym planie opieki lub protokole leczenia; w związku z tym, aby dokładniej omówić powyższy temat, prosimy o kontakt Dr Alex Jimenez, DC, lub skontaktować się z nami pod adresem 915-850-0900.
Jesteśmy tutaj, aby pomóc Tobie i Twojej rodzinie.
Błogosławieństwa
Dr Alex Jimenez OGŁOSZENIE, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-mail: coach@elpasofunctionmedicine.com
Licencjonowany jako lekarz chiropraktyki (DC) w Texas & Nowy Meksyk*
Licencja Texas DC nr TX5807, Licencja DC w Nowym Meksyku nr NM-DC2182
Licencjonowana pielęgniarka dyplomowana (RN*) in Floryda
Licencja Florydy Licencja RN # RN9617241 (nr kontrolny 3558029)
Stan kompaktowy: Licencja wielostanowa: Uprawniony do wykonywania zawodu Stany 40*
Dr Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja cyfrowa wizytówka